Acta Odontologica Scandinavia,
Sigvard Palmqvist, Associate Professor, odont. dr.
Björn Söderfeldt, Professor, phD et dr. Med. Sc.
Merete Vigild, Associate Professor, dr. et lic. odont.
Jakob Kihl, Dentist, Dental Surgeon


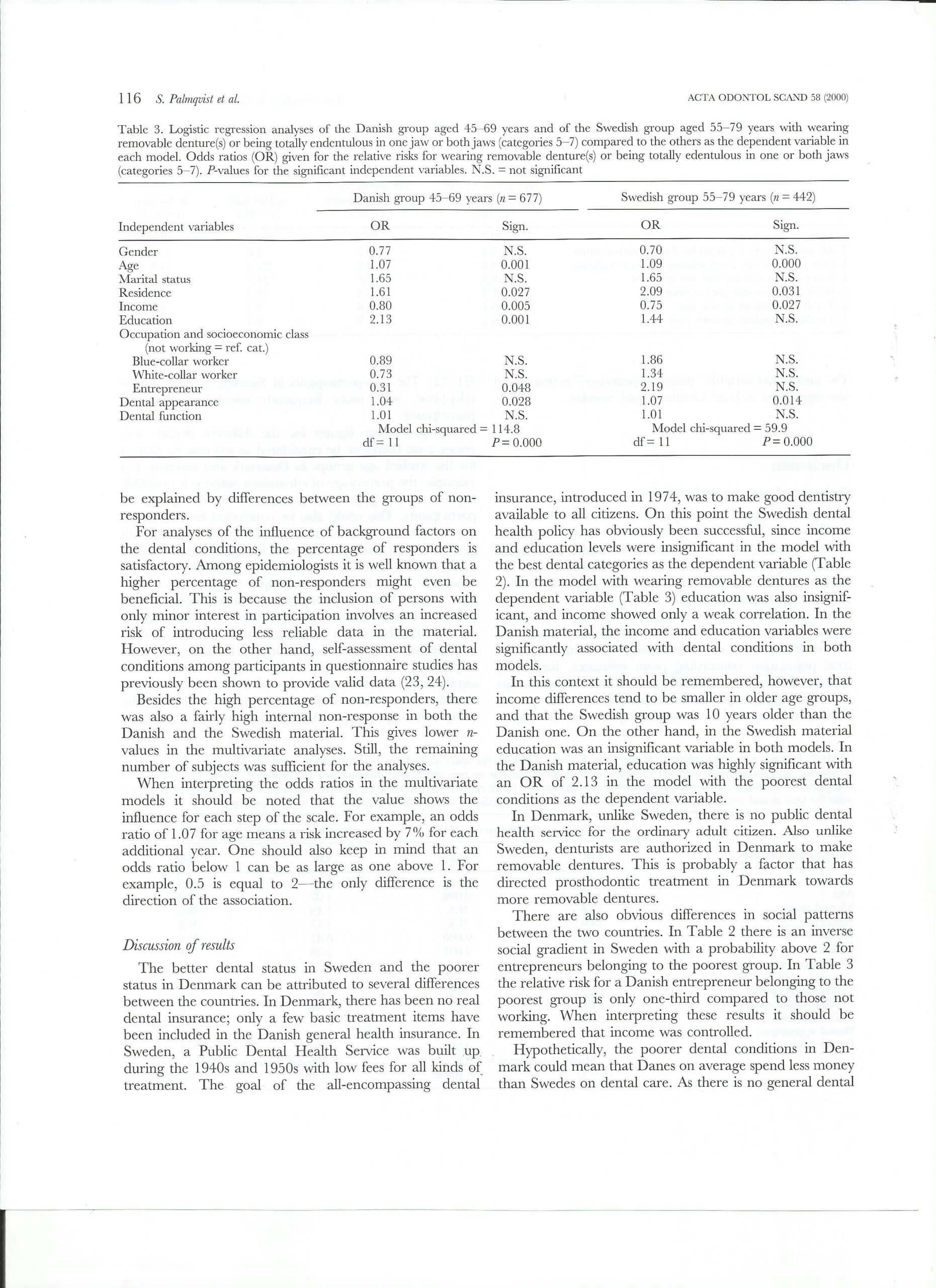


Acta Odontologica Scandinavia,
Sigvard Palmqvist, Associate Professor, odont. dr.
Björn Söderfeldt, Professor, phD et dr. Med. Sc.
Merete Vigild, Associate Professor, dr. et lic. odont.
Jakob Kihl, Dentist, Dental Surgeon






© COPYRIGHT 1988, Odontologisk Boghandels Forlag, København
Forfatter: Tandlæge Jakob Kihl
Det Kongelige Bibliotek REX (KUB4-2013-1924)






Forfatter, Tandlæge Jakob Kihl: Introduktion til dental metal keramik | Odontologisk Boghandels Forlag | København |EAN/ ISBN-13: 9788774939719
Metal keramik | MK | Porcelain-Fused-to-Metal | PFM | VMK | Porcelæn påbrændings kroner.
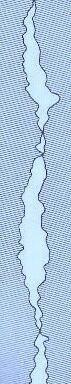
Unøjagtigheden af en krone kan defineres som graden af disharmoni mellem kronen og den naturlige tandoverflade.
Foto ovenfor viser spalte mellem krone og tand.
Denne disharmoni – unøjagtighed – eller dimensionel diskontinuitet af kroner kan være større eller mindre, og interessen er specielt centreret omkring overgangen mellem krone og tand: Kantpræcisionen.
Mangelfuld kantpræcision ved behandling med kroner eller broer er langt den hyppigste årsag til de sekundære skader på tand og tandkød. Forebyggelse af sådanne skader sker væsentligt ved forøgelse af præcisionen.
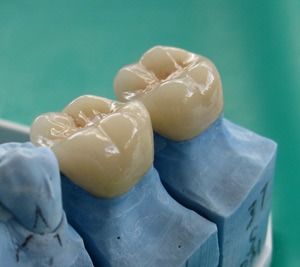
Spaltebredden mellem krone og tand angives veldokumenteret til maksimalt at måtte være 50 µm.
Overstiger spalten 50 µm vil bakterier kunne sidde uforstyrret og bakterielle stofskifteprodukter vil trænge ind igennem disse spalter.
Foto viser palte over 50 µm mellem krone og tand med massiv bakterievækst
Optimalt er en spaltebredde på 15 µm , hvorved der lige akkurat opnås plads til de største korn i den cement, som anvendes til permanent at fastholde kronen til tanden.
Nyere og billigere kronetyper har ofte en spaltebredde på over 200 µm.
Dette forsvares med anvendelse af plast som cement til permanent fastholdelse af kronen, men dette er kritisk, da plast skrumper (og dermed efterlader spalter), plast binding er meget følsom for fugt ved cementering og plast anvendt som cement er under mistanke for at skade det omgivende tandkød.
Man kan sammenligne det med at samle kantlister med “håndværker” fugning med silikone i stedet for at skære dem i smig.
100% pasning mellem krone og tand er tidligere blevet anset for den optimale pasform, bl.a. fordi at man troede at måtte forlange, at kronerne i kraft af deres friktion på de indvendige flader mod resttand skulle udvise tilstrækkelig egen retention uden anvendelse af cement. Da krone og tand ikke berører hinanden efter cementeringen, men er adskilt af et tyndere eller tykkere cementlag, er en “glidepasning” med lige akkurat plads til cementeringsmidlet den optimale præcision.
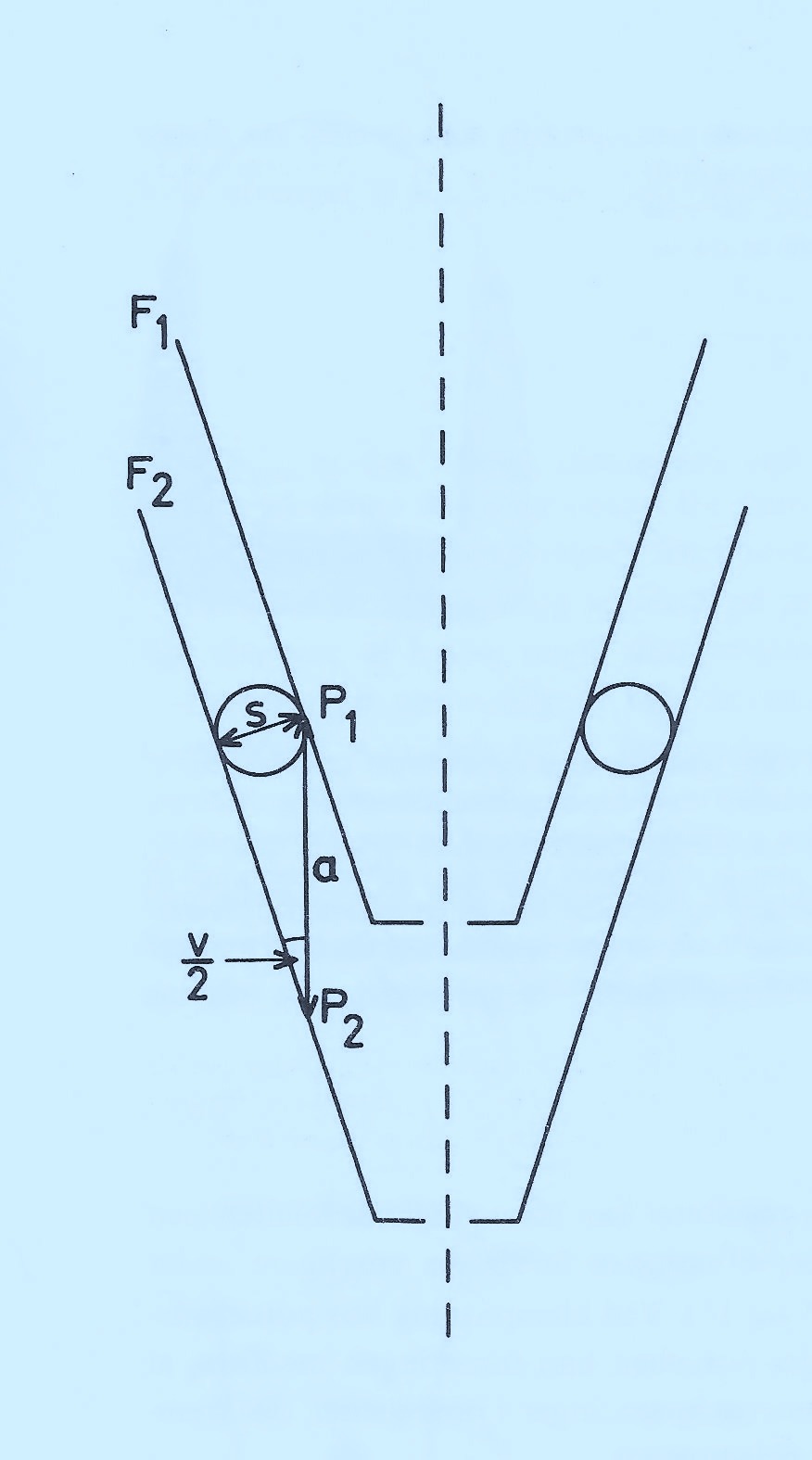
Principskitsen ovenfor illustrerer dette. De konvergerende flader F1 og F2 er kongruente men kan ikke bringes i kontakt med hinanden pga. den indskudte cementfilm, S ,hvis dimension kan repræsentere de groveste korn i cementen.
Kronen (F1) vil udvise en unøjagtighed, vist som a (aksial diskrepans), hvor v er vinkelen til udslibningen af kronen (konvergensvinkel).

Den optimale præcision af en krone skal derfor lige akkurat være “unøjagtig” til at der gives plads til 15-20 µm cement.
Det er typisk for kontaktforholdet mellem to ru overflader, at de to overflader kun berører hinanden i punkter og relativt langt fra hinanden liggende punkter, og at afstanden mellem fladerne i andre områder er større, jo mere ru overfladerne er. Kroner fx fremstillet i keramik fræset mekanisk med skiver eller bor vil have en stor ruhed, og cementfilm tykkelsen vil lokalt blive særlig tyk. Her er 3-D print kroner mere lovende af de nye alternative krone typer, da printning kan ske ned til 50 μm.
 Tyk cementfilm skrumper forholdsvist mere (volumen%) end tynd cementfilm og har en øget porøsitet. Begge dele giver anledning til sprækker og hulrum, hvor bakterier vil vokse. Ligeledes vil tilhæftning af kronen mere bero på cement end på kontakt mellem krone og tand. Det vil derfor mere være cementens styrke end kronens styrke, der holder kronen på plads.
Tyk cementfilm skrumper forholdsvist mere (volumen%) end tynd cementfilm og har en øget porøsitet. Begge dele giver anledning til sprækker og hulrum, hvor bakterier vil vokse. Ligeledes vil tilhæftning af kronen mere bero på cement end på kontakt mellem krone og tand. Det vil derfor mere være cementens styrke end kronens styrke, der holder kronen på plads.Det kan sammenlignes med en murstensvæg, hvor der er for stor afstand mellem murstenene, og det mellemliggende mørtel lag er blevet for tykt.
Ønsker man garanti for en krone med høj præcision og deraf følgende dokumenteret og gennemprøvet lan levetid, er fx en MK krone med inderkappe i højædel legering det rigtige. Læs mere om denne kronetype her

Alveoleknoglen er opbygget af to typer knoglevæv, nemlig den kompakte ydre cortikale knogle (cortex) og en inderkerne af spongiøs trabekulær knogle (gr. spongia: svamp).
Den kompakte knogle beklæder knoglens overflader og består af fibre i en ensartet, tæt masse af mineraliseret grundsubstans. Den indeholder endvidere celler, osteocytter, og er til forskel fra rodcementen rig på nerver og blodkar, som den modtager fra såvel knoglemarven som benhinden, periost. Selve alveolen er også beklædt med kompakt knogle ind imod rodhinden, men knoglen er her mindre tæt end på de ydre flader, idet den gennemhulles af talrige småkar og nerver samt giver fæste til rodhindefibrene.
Den spongiøse knogle indeholder de samme byggestene som den kompakte, men har en anden struktur. Den består af et løsere netværk af knoglebjælker (trabekler) af forskellig tykkelse og retning, og imellem disse knoglemarv med kar, nerver, fedtceller og bindevæv (spongiosa).

Strukturerne i de to typer knoglevæv genfindes også på røntgenbillederne Den spongiøse knogle fremtræder som et netværk af knoglebjælker, mens den kompakte viser sig som en hvid linie på knoglens overflade og langs rodhinden. På sidstnævnte sted kaldes den ofte lamina dura.
Knoglevævet er opbygget af osteoner, som centralt har en Haversk kanal. Osteocytter er indfanget i lakuner mellem de koncentriske lag af knogle rundt om den Haverske kanal. Der ses forbundne kanaler horisontalt på de Haverske kanaler ; disse kaldes Volkmann´s kanaler. På overfladen af knoglevævet ses osteoblaster og osteoklaster. Osteoblasterne er i stand til at producere osteoid, som mineraliseres, hvorved knoglevæv dannes

Alveoleknoglen undergår konstant forandringer i form af nydannelse og nedbrydning af knoglevæv. Osteocytterne omdannes enten til osteoblaster ( knogledannende celler ) eller osteoklaster ( knogleresorberende celler ). Selv små ændringer i tændernes funktion fører hurtigt til ombygningsprocesser i knoglevævet.

Ændret belastning af en tand vil således igangsætte processer, som tilpasser knoglevævet til de nye omstændigheder. Konstant forøget belastning inden for fysiologiske rammer vil i det spongiøse knoglevæv føre til en tættere struktur med tykkere knoglebjælker. Det kompakte knoglevæv i alveoleknoglen fortykkes, og flere rodhindefibre indkorporeres. Formindsket belastning eller manglende stimulering af parodontiet efter ekstraktion af antagonister fører til omtrent de modsatte reaktioner i knoglevævet.
Illustrationen viser osteoblast ( centrum ) i knoglevæv. Denne knoglecelle findes først og fremmest i knoglevæv i områder med ny knoglevækst. Osteoblaster producerer osteoid, en matrix af nyt knoglevæv bestående af kollagen fibre og andre strukturelle proteiner. Såsnart osteoid er dannet, vil knoglesaltekrystallisere indvendig i massen og danne hård, mineraliseret knogle.
Men for ombygningsprocesserne gælder, dels at den vigtigste knoglenydannelse sker ved, at osteoblaster fra rodhinden producerer ny knogle langs alveolevæggen, og dels at nedbrydningen (knogleresorptionen) sker som følge af osteoklasternes aktivitet de samme steder.

Osteoklasterne er store multinukleære celler, der ofte ligger i resorptioner, de såkaldte Howship´s lakuner, på selve knogleoverfladen. Osteoklasterne er i stand til at nedbryde knoglevæv. De secernerer organiske syrer, der opløser hydroxylapatiten. Hydroxylapatit er hovedkomponenten i knoglevæv. Efter denne demineralisation nedbrydes knoglens organiske matrix, idet osteoklasten afgiver lysosomale enzymer.
Naturligt sker en forøgelse af den vertikale knoglehøjde med alderen. Alveoleknogle opstår og forsvinder ved tandudvikling af tænder og tab af tænder. Dette skyldes tilstedeværelse af osteoblaster, som indgår i remodelleringsprocessen, og osteoklaster der indgår i resorptionsprocessen. Naturligt resorberes 100 µm / 0,1 mm om året. Ved aktiv parodontitis eller calcium ubalance( fx nyreinsufficiens )resorberes med en hastighed X 2; ved tab af tænder med en hastighed X 10. Ved urinprøvetagning må calciumtesten ikke overstige en værdi på 100 mg/ml.
I modsætning til den meget stabile basal knogle (basal bone) i det almindelig knogleskelet er alveoleknogle meget ustabil og spongiøs. Karakteristisk for alveoleknogle er, at den er højt vaskulariseret, højt specialiseret, meget ustabil, og støtter tændernes modstandskraft mod parodontitis. Dermed har nyreinsufficiens, diabetes og andre sygdomme indflydelse på udvikling af parodontitis.
Alveolen er betegnelsen for den fordybning i knoglen, som ved hjælp af parodontalligamentet er forbundet med rodcementen. Parodontalligamentet ”beskytter” også mod knoglens osteoklaster. Hvis osteoklaster støder mod en rodoverflade uden parodontalligament, tror osteoklasterne, at det er en død knogle, der skal fornyes. Derved påbegyndes en resorption af tandoverfladen udført af knoglens osteoklaster. Derfor forsvinder fx efterladte rodstumper efter tandudtrækning med tiden, idet de resorberes af osteoklasterne.

Alveoleknoglens form er betinget af tændernes tilstedeværelse, idet den opbygges omkring tænderne, efterhånden som disse bryder frem, og nedbrydes, når tænderne mistes. Som hovedregel gælder, at alveolen omslutter tændernes rødder på alle sider, dog således at alveolens overkant konstant ligger i en afstand af 1-2 mm fra emaljecementgrænsen.
Såvel alveoleknoglen som gingivalranden følger dermed emaljecementgrænsens bugtede forløb, knoglen 1-2 mm apikalt for, og gingivalranden 1-2 mm koronalt for grænsen.
Alveole knogle kan udvise variationer fra maxil ( overkæbe ) ( tyndere cortikal knogle, dermed højere ustabilitet og mere vaskulariseret) til mandibel ( underkæbe ) (tykkere cortikal og trabekulær knogle, mindre vaskularisation) og individuelt, hvorfor knoglekvaliteten kan inddeles i (Misch/Judy 1985):
1. Type 1 Tæt cortikal knogle
2. Type 2 Porøs cortikal knogle og kraftige trabekler i spongiosa.
3. Type 3 Tynd porøs cortikal knogle og tynde spongiosa-trabekler
4. Type 4 Tynde spongiosa-trabekler og ringe mængder eller ingen cortikal knogle. Konsistens som skumplast
Inddelingen bygger på røntgen og direkte inspektion ved operationer. Til mere nøjagtig bedømmelse kan CBCT, CAT-SCAN eller MRI analyse anvendes.

Blodforsyningen til alveoleknoglen kommer overvejende ( 80% ) fra gingiva & parodontalligamentet, som dræner alveoleknoglen igen med 100%. Denne balance kan kompromitteres ved kemoterapi, hvorfor cancerpatienter er særligt udsatte for fæstetab af alveoleknogle.
Tykkelsen af den knogle, som omgiver rødderne, er forskellig fra tand til tand og fra person til person. I underkæben er knoglen omkring fortænderne samt facialt for hjørnetænder og præmolarer ofte tynd, hvilket kan iagttages ved, at knogle og gingiva på disse steder antager form efter de underliggende, fremtrædende rødder. Bagtil i underkæben, især facialt men også lingualt for molarerne, er knoglen derimod kraftig. I overkæben er knoglen facialt for hjørnetænderne samt facialt for 1. molars mesiofaciale rod ofte tynd, mens den palatinalt overalt er kraftig. I områder, hvor røddernes knogledække er særligt tyndt, er det ikke ualmindeligt, at dele af knoglen helt mangler. Det kan ske i form af et isoleret hul i knoglepladen og kaldes da et knoglefenester eller i form af en kløft i knoglepladen og kaldes da en knoglereces. På disse steder er gingivas bindevæv fæstet direkte til tandoverfladen.
Der findes to typer cement:
1) Primær cement/acellulær cement.
2) Sekundær cement/cellulær cement.
Primær cement dannes under tanddannelse og eruption af cementoblaster differentieret fra fibroblaster. Sekundær cement dannes efter eruption idet tanden responderer på den funktionelle påvirkning. Under denne proces inkorporere cementoblaster i cementoid, som mineraliseres og danner cement. Cellerne, som bliver inkorporeret i lakuner, kaldes cementocytter. I cementen insererer parodontal ligament fibrene, idet fibrene udgår vinkelret fra dentin-cementgrænsen og hæfter i alveoleknoglen. I den del, fibrene er indeholdt i cementen, er de mineraliseret. Cementoblasterne danner fibre, som er parallelle med tandens akse, og som er beliggende i cementen.
Som tidligere nævnt undergår cement kun begrænset resorption eller remodellering. Tykkelsen af cementlaget stiger i takt med funktionstiden.
Rodcementen hører til de hårde tandvæv. Det er et forkalket (mineraliseret) væv, der som et tyndt lag beklæder hele tandroden uden på dentinen. Det er tyndest nær tandhalsen (ca. 50 µm) og tykkest omkring rodspidsen (ca. 150 µm).
Emaljecementgrænsen kan være udformet forskelligt. I enkelte tilfælde berører emalje og cement ikke hinanden, men adskilles af et smalt bælte af blottet dentin. I andre tilfælde støder cement og emalje sammen kant imod kant. Men det almindeligste er, at cementen overlapper emaljen en smule. Emaljecementgrænsen forløber normalt bugtet omkring tanden. Forløbet kan dog være uregelmæssigt, især nær furkaturerne, hvor emaljeudløbere eller emaljeperler er ret almindelige.
Rodcementen har først og fremmest betydning som det væv, der forankrer rodhindens fibre i tanden. Rodcementen findes i to typer. Primær cement dannes samtidig med rodudviklingen og tandfrembruddet. Men derudover er det karakteristisk, at en vis pålejring af ny cementsekundær cementkan ske igennem hele livet. Nydannelsen foregår fra rodhinden, hvor cementoblasterne findes. Langs rodcementen dannes et uforkalket forstadium til rodcement, kaldet cementoid. Dette lags tilstedeværelse synes at være af afgørende betydning for rodcementens vitalitet og for konstant fornyelse af fibrenes fæste i rodcementen. Rodcementen ligner på flere måder kompakt knoglevæv, men cementen indeholder ikke nerver og blodkar, idet den forsynes hermed fra rodhinden.
Til forskel fra parodontiets knoglevæv er resorption ikke almindelig. Cementoidlaget synes at beskytte den mineraliserende cement herimod, hvorfor cementen med alderen kan blive 23 gange tykkere.
De faktorer, der regulerer pålejringen af sekundær rodcement og i sjældne tilfælde sekundær rodcement og i sjældne tilfælde rodresorptioner, er tildels ukendte.
Udvikling af tandroden og cement
Forfatter, Jakob Kihl © 2014
Menneskets hud og slimhinder i fordøjelseskanalen og de øvre luftveje huser en normal mikroflora, hvis sammensætning varierer med lokalisationen. Således har mundhulen en meget talrig og kompliceret mikroflora.
Kendskab til mundens mikroflora er vigtig af flere grunde: Under tandbehandling kommer patientens mundflora på hænderne af tandlægen og på de anvendte instrumenter. Desuden vil forurenede dråber sprøjte ud af patientens mund, specielt ved brug af spray, luftpuster og vandkølet bor. Bakterier fra mundfloraen vil derfor findes i luften, på bordplader, døre, gulve osv.
Se nærmere under klinikhygiejne.
For at opretholde en høj standard af klinikhygiejne bør man kunne vurdere den smitterisiko, som kan være til stede, og eliminerer mulighederne for forurening.
En del af den normale mundflora sidder fast på tænderne som bakteriebelægninger (plaque) (foto) og kan derved blive årsag til caries og gingivitis. For at forstå disse sygdommes opståen og forebyggelse er det nødvendigt at kende plaquens udvikling og sammensætning.

Til den normale mundflora regnes:
Normalt lever bakterierne i harmoni med værten og udgør den
= normalfloraen, der virker :

Den konstante mundflora findes primært på tænders og slimhinders overflader, hvor de sidder fast med forskellige adhæsionsmekanismer. Sådanne ansamlinger af mikroorganismer findes på steder med retentionsmuligheder, hvor mikroorganismerne ikke så let slides af, det vil sige på tænderne (især langs gingivalranden, i fissurer og i eventuelle cariesangreb) samt på tungeryggens slimhinde. På de glatte slimhinder er floraen mere sparsom. En del af mikroorganismerne løsrives fra deres lokalisation ved epiteldeskvamation fra slimhinderne og ved mekaniske påvirkninger under tygning og anden muskelfunktion. Således får saliva en righoldig mikroflora, som imidlertid stadig fjernes fra munden ved synkning af saliva.
Den konstante mundflora kan virke beskyttende mod invasion af patogene mikroorganismer ved forskellige mekanismer, som tilsammen kaldes mikrobiel antagonisme. Som eksempler kan nævnes konkurrence om substrat og udskillelse af hæmmende stofskifteprodukter. Bakteriefrie dyr er forsøgsdyr født med en steril operationsteknik og holdt i et sterilt miljø i særlige beholdere med sterilfiltreret luft og autoklaveret føde og drikkevand. Når sådanne dyr kan trives og føde unger beviser det, at en mikroflora ikke er livsnødvendig. Det har dog vist sig, at sådanne dyr skal have tilført K-vitamin og forskellige B-vitaminer, som hos konventionelle dyr produceres af den normale mikroflora i tarmen og muligvis i munden. De bakteriefrie dyr har et lavt immunglobulin-indhold i deres serum og deres modtagelighed for bakterielle infektioner er stærkt forøget.
Ved ydre påvirkninger eller sygdom opstår den
Der bla. kan indeholde patogener.
Mikroorganismer, som optræder inkonstant i munden, kan stamme fra huden, svælget, føden eller fra vores omgivelser i øvrigt. Mange forskellige mikroorganismer kommer ind i munden, men hvis de ikke er tilpasset det specielle miljø, vil de ikke klare sig dér ret længe. De har også svært ved at konkurrere med alle de konstante mikroorganismer om næring, plads osv. Inkonstante mikroorganismer i munden kan imidlertid også være forskellige patogene bakterier og virus. Patogene mikroorganismer kan nem1ig findes i svælget og i munden ved mange infektionssygdomme, fx ved forkølelse, influenza, halsbetændelse, børnesygdomme, lungebetændelse, hjernehindebetændelse, tuberkulose, leverbetændelse, gonoré, syfilis, kopper. Sådanne sygdomme kan derfor smitte ved direkte kontakt med patientens mund, nogle tillige ved indirekte kontakt og indånding af dråber eller støv. Der er ikke blot risiko for smitte ved patienter med kliniske tegn på sygdom, men også i sygdommenes inkubationstid (tiden fra man er smittet, til sygdommen bryder ud). Infektionssygdomme kan i nogle tilfælde forløbe så mildt, at de ikke opdages, men sådanne subkliniskeinfektioner frembyder alligevel en smitterisiko. Endelig findes der sunde smittebærere, som udskiller patogene bakterier uden selv at blive syge. Foruden i de oplagte tilfælde af infektionssygdomme blandt patienter og personale på tandklinikken kan der altså udmærket være en smitterisiko hos raske eller tilsyneladende raske mennesker.
Normalflora virker normalt ikke sygdomsfremkaldende, men under særlige omstændigheder kan den blive det, hvorved der opstår en :
Tilstedeværelse og multiplikation af mikroorganismer i levende væv
En variant af infektion er den :
Apatogen mikroorganisme introduceres i nye omgivelser; fx Staphylococcus epidermis , der på en “bussemand” introduceres i sår eller mund.
De fleste infektionssygdomme i munden er endogene.
En skadelig forskydning i balancen mellem vært og mikroflora kan opstå ved nedsat resistens hos værtsorganismen (lokalt eller generelt), ved forøgelse af floraens virulens eller ved ophobning af et forøget antal mikroorganismer, fx i tandplaque. Sygdomme, som således under særlige omstændigheder fremkaldes af en normal flora, kaldes endogene infektioner.
Insufficient mundhygiejne > øget bakteriemængde > forskydning af mikrofloras sammensætning > skade på tandvæv > videreudvikling giver mulighed for dybe infektioner i submucosa og kæbeknogle med endogene infektioner af fremmede mikroorganismer. Som eksempler kan nævnes :
Aktinomykose
Candidose/candidiasis
Caries
PARODONTITIS

Den konstante flora kan også forårsage sårinfektion og sygdom andre steder i værtsorganismen, hvis den ved et traume kommer ind i vævene.
Således kan mundhulens streptokokker og andre orale bakterier ofte få adgang til blodbanen ved tandrensning, tandekstraktioner og andre operationer i mundhulen. Normalt fjernes disse bakterier hurtigt, men hvis patienten bar en i forvejen tilstedeværende organisk hjertefejl, kan de blive årsag til subakut bakteriel endocarditis, som altså også er et eksempel på en endogen infektion.
Forbigående bakteriæmi (forekomst af bakterier i blodet) med plaquebakterier fra mundhulen er meget almindelig ved tandudtrækninger, tandrensning og anden mekanisk påvirkning af tand og gingiva, men hos de fleste mennesker elimineres bakterierne fra blodbanen på få minutter. Hos enkelte mennesker, som er prædisponeret herfor ved at have defekter i hjerteklapper, By-pass eller andre defekter i hjertet, kan en sådan bakteriæmi føre til subakut bakteriel endocarditis. Denne sygdom kan skyldes Streptococcus sanguis, som blev isoleret fra blodet af sådanne patienter, længe før man opdagede, at den primært er lokaliseret i plaque på tænderne. Deraf navnet Sanguis : ”blod”. Sygdommen kan dog også skyldes andre orale bakterier (fxStreptococcus mutans) eller den kan opstå ved bakteriæmi udgået fra andre regioner end mundhule
Mennesker med tandkødsbetændelse eller parodontitis har altså en konstant risiko for infektion med bakterier i blodbanen (bakteriæmi).
Sårinfektion
Traume
Depuration
Ekstraktion
Den normale mundflora er altså potentielt patogen, det vil sige den har patogene muligheder og fremkalder sygdom under særlige omstændigheder
I visse tilfælde skal patienten minimum 1 time før tandrensning have indtaget antibiotikum svarende til 1 MIE Penicillin.
Denne profylaktiske anvendelse af antibiotika er indiceret :
l.Hos visse risikopatienter, hvor bakteriæmi kan forårsage alvorlige komplikationer.
2. Ved visse indgreb for at nedsætte risikoen for lokal infektion.
· Dybere tandrensning ( parodontalbehandling )
· Operation incl. biopsitagning
· Tandudtrækning
· Rodbehandling
Plaque anses i dag som den vigtigste kilde til bakteriæmi af oprindelse fra mundhulen.
Fokalinfektionsteorien går kort fortalt ud på at en lokal, velafgrænset vedvarende infektion, (primær focus, lat. focus = ildsted ) er årsag til infektion eller inflammation, (sekundær affektion), andetsteds i kroppen.
Det anbefales at risikopatienter som skal dækkes profylaktisk med antibiotika før en bakteriæmifremkaldende behandling, også skyller munden med 0,2% Klorhexidin i 30 sek. før behandling.
Ændring af modstandskraft eller miljø: Porphyromonas gingivalesfindes hos sunde men udløser infektion i de parodontale væv ved nedsat modstandskraft.

Op mod 400 forskellige bakteriearter er påvist i mundhulen, og dertil kommer gærsvampe, mykoplasmer og protozoer. Floraen er imidlertid så kompliceret og så lidt udforsket, at man langtfra kan give en fuldstændig redegørelse for alle mikroorganismernes klassifikation og egenskaber. Der hersker end ikke enighed om navnene.
Man må gøre sig klart, at ikke alle orale organismer kan dyrkes, og at mange af mikroorganismerne er ufuldstændigt udforsket, så en nøjagtig identifikation ofte er umuligDerfor nøjes man ofte med en oversigtsmæssig inddeling efter Gram reaktion (±), cellemorfologi (kok,stav,etc.) og cellelejring, samt i aerobe, fakultative og anaerobe.
De hyppigst forekommende arter er streptokokker.
Streptokokker er grampositive kokker, kugleformede eller ovoide (mindste diameter 0.5 – 0.8 µm) anordnet i kortere eller længere kæder. De er ubevægelige og danner ikke sporer.
Streptokokker er fakultativt anaerobe og katalase-negative. Kulhydrater (fx glukose, galaktose, fruktose, mannose, sakkarose, laktose og maltose) forgæres under syreproduktion ved en homofermentation, det vil sige, der dannes overvejende mælkesyre.
Klassifikationen af streptokokker er baseret på hæmolytiske egenskaber, antigenstruktur, biokemiske egenskaber og resistens over for fysiske og kemiske faktorer.
Her skal kun omtales de i mundhulen forekommende streptokokker. Streptokokker udgør en væsentlig del af mundfloraen, nemlig omkring halvdelen af de dyrkbare mikroorganismer på tungeslimhinden og omkring en fjerdedel af de dyrkbare mikroorganismer i tandplaque. De fleste tilhører viridans-gruppen og resten enterokokkerne. Pyogene (hæmolytiske) streptokokker kan lejlighedsvis isoleres fra mundhulen i forbindelse med deres forekomst i svælget, men de hører ikke til den konstante mundflora og har ingen betydning for sygdomme i mundhulen. Mælkesyrestreptokokker findes i mange syrnede mælkeprodukter, som indgår i vores føde, men de træffes kun sjældent i munden, hvor miljøet åbenbart ikke er passende for dem.
Mitis Salivarius Agar er et selektivt substrat til isolering af viridans-streptokokker og enterokokker. Substratets indhold af trypanblåt, krystalviolet og tellurit hindrer væksten af andre bakterier. Desuden indeholder Mitis Salivarius Agar 5% sakkarose, hvilket muliggør en vis differentiering mellem forskellige streptokok-arter, fordi evnen til at producere extracellulært polysakkarid ud fra sakkarose afspejles i kolonimorfologien.
Viridans-streptokokkerne er en heterogen gruppe af streptokokker. De udgør langt den overvejende del af mundhulens streptokokker.

Streptococcus mutans vokser dårligt under aerobe forhold, idet den er mikroaerofil. I en anaerob atmosfære med 5% Co2 danner den på Mitis Salivarius Agar karakteristiske kolonier, som er 0,5 – 1,0 mm, højt konvekse, med en granuleret struktur af udseende som sandblæst glas. På grund af polysakkaridsyntese ud fra sakkarose ser man ofte en vandklar dråbe på toppen af kolonien. Hvis der dannes større mængder, kan polysakkaridet løbe ned og lægge sig som en sø rundt om kolonien. Polysakkaridet dannes ekstracellulært ud fra sakkarose, ikke fra andre sukkerarter. Det består overvejende af glukan og indeholder mindre mængder fruktan. Streptococcus mutans forgærer sorbitol i modsætning til de øvrige viridans-streptokokker. Streptococcus mutans er primært lokaliseret i plaque, hvor de udgør en stærkt varierende del af streptokokfloraen (0 – 90%). Hos cariesinaktive individer udgør de ofte under 5%, mens de hos individer med høj cariesaktivitet kan udgøre 50 -90% af streptokokfloraen i plaque på cariesaktive tandflader. Stammer af S. mutans i sakkaroseholdige bouillonkulturer vokser fast på glassets inderside og på tænder, ståltråde og lignende, som stikkes ned i kulturerne. De kan også inducere plaquedannelse hos hamstre og monoinficerede, gnotobiotiskerotter på sakkaroseholdig kost. ( Gnotobiotisk : Med kendt mikroflora. Isolerede dyr, som holdes bakteriefrie eller inficeres med en enkelt eller nogle få kendte bakteriestammer).

S. Mutans er altså primære plaquedannere (P), det vil sige, de kan kolonisere overflader uden hjælp af andre mikroorganismer. I dyreforsøg inducerer S. mutans foruden plaquedannelse også caries og en marginal parodontitis med knoglenedbrydning. De kaldes hyppigt cariogene streptokokker, og deres rolle for human caries udforskes ivrigt.
Streptococcus sanguis vokser under såvel aerobe som anaerobe forhold. På Mitis Salivarius Agar danner den karakteristiske kolonier, 0,5 – 1,0 mm i diameter, af fast konsistens, stærkt adhærerende til agaroverfladen. Den danner ekstracellulært glukan ud fra sakkarose, men ikke af andre sukkerarter.
Streptococcus sanguis er primært lokaliseret i plaque på tænderne, hvor den ofte udgør over halvdelen af streptokokfloraen. I cariesaktiv plaque udgør den ofte en mindre del af streptokokfloraen end i cariesinaktiv plaque. Den er blandt de første mikroorganismer, som koloniserer rengjorte tænder, og den kan danne “plaque” på ståltråde in vitro. Dermed er S. Sanguis en primær plaquedanner (P). Derimod er det kun sjældent lykkedes at få den til at danne plaque på tænderne af forsøgsdyr, og dyrene får kun lidt caries.
S. sanguis isoleres hyppigt fra blodet af patienter med subakut bakteriel endocarditis. Forbigående bakteriæmi med plaquebakterier er meget almindelig ved tandekstraktioner, tandrensning og anden mekanisk påvirkning af tand og gingiva, men hos de fleste mennesker elimineres bakterierne fra blodbanen på få minutterHos enkelte mennesker, som er prædisponeret herfor ved at have defekter i hjerteklapper, By-pass eller andre defekter i endocardium, kan en sådan bakteriæmi føre til subakut bakteriel endocarditis. Denne sygdom kan skyldes S. sanguis, som blev isoleret fra blodet af sådanne patienter, længe før man opdagede, at den primært er lokaliseret i plaque på tænderne. Deraf navnet Sanguis : ”blod”. Sygdommen kan dog også skyldes andre orale bakterier (fxS. mutans) eller den kan opstå ved bakteriæmi udgået fra andre regioner end mundhulen.


Streptococcus salivarius vokser under såvel aerobe som anaerobe forhold. På Mitis Salivarius Agar dannes store (2 – 5 mm) lyseblå, glatte, mukoide kolonier. Den syntetiserer ekstracellulært fruktan og mindre mængder glukan ud fra sakkarose, men ikke af andre kulhydrater. Streptococcus salivarius er primært lokaliseret på tungeryggen, hvor den udgør over halvdelen af streptokokfloraen. I plaquen synes miljøet ikke at være gunstigt for Streptococcus salivarius, her udgør den i reglen kun ca. 1% af streptokokfloraen. Denne procent kan dog blive noget højere ved hyppig indtagelse af sakkarose. Stammer af 5. salivarius har vist sig at kunne danne “plaque” på ståltråde in vitro (P). Hos monoinficerede gnotobiotiske rotter danner de plaque på tænderne og forårsager caries og marginal knogle-resorption. Deres rolle ved plaquedannelse, caries og marginal parodontitis hos mennesker er dog sandsynligvis ringe, jævnfør at de udgør en meget lille del af plaquefloraen på tænderne.
Streptococcus mitis er i praksis en samlegruppe for viridans-streptokokker, som ikke passer ind i de øvrige, mere veldefinerede arter. Streptococcus mitis danner på Mitis Salivarius Agar små (0,2 – 1,0 mm) glatte kolonier af forskelligt udseende og producerer ikke ekstracellulært polysakkarid fra sakkarose. De udgør en biokemisk heterogen gruppe. Disse streptokokker findes på slimbinderne i munden og i næsesvælgrummet, samt i plaque.
To arter er udskilt fra S. mitis gruppen, idet de kan karakteriseres ved forskellige biokemiske prøver. Det er Streptococcus mitior, som findes på mundhulens glatte slimhinder og i tandplaque, samt Streptococcos millerisom er lokaliseret i plaque og tandkødslommer.
Foruden ovennnævnte viridans-streptokokkerkan der findes enterokokker i mundhulen, selv om de primært findes i tarmkanalen. Enterokokkerne tilhører serologisk gruppe D, udviser varierende hæmolyse, og er karakteriseret ved at vokse under betingelser, der normalt anses for ugunstige (ved 10º og 45° og ved pH = 9.6). De vokser på Mitis Salivarius Agar med små, glatte kolonier og danner ikke ekstracellulært polysakkarid.
De obligat anaerobe streptokokker er udskilt fra de fakultativt anaerobe streptokokker og er samlet i en genus: Pepto-streptococcus. Det er gram-positive kokker lejret i kæder ligesom streptokokkerne, og er iøvrigt en heterogen gruppe, hvis medlemmer varierer med hensyn til hæmolyse, proteolyse og andre egenskaber. De udgør 5-10% af mundhulens bakterier. De isoleres ofte fra ildelugtende pyogene processer, gerne sammen med andre anaerobe bakterier (anaerob blandingsinfektion).
Både stafylokokker er gram-positive kokker, ca. 1 µm i diameter, lejret i hobe. De er ubevægelige og danner ikke sporer. Stafylokokker er katalase-positive og er fakultative, men vokser bedst aerobt. De kan dyrkes på simple substrater og forgærer en række kulhydrater under produktion af mælkesyre både under aerobe og anaerobe forhold.
Staphylococcus aureus og Staphylococcus epidermidis findes primært på huden og næseslimhinden og optræder kun in-konstant og i ringe antal i mundhulen. Overføring af S. aureus mellem tandlæger/tandplejere og deres patienter synes ikke at give anledning til problemer (i modsætning til forholdene på sygehuse). Blandt tandlægestuderende synes der heller ikke at være nogen stigning i antallet af stafylokokbærere i løbet af den kliniske del af studiet.
Actinomyces findes i mundhulen og svælget og udgør 25% af plaque. Visse stammer er primære plaquedannere (P) og kan fremkalde caries og marginal parodontitis. Forgærer kulhydrat (sakkarose) og kan danne ekstracellulært polysakkarid.
En Actinomyces art: Actinomyces israelii findes normalt i mundhulen, og kan udover caries & PA forårsage en Actinomykose, en endogen kronisk infektion, der er karakteriseret ved hårde, knudeagtige abscesdannelser med fistler.

Lactobaciller er gram-positive stave af varierende længde. De er ubevægelige og danner ikke sporer.
Laktobaciller er fakultativt anaerobe, nogle er dog obligat anaerobe. De er katalase-negative og danner store mængder syre ved forgæring af almindeligt forekommende sukkerarter (acidogene). De betegnes ofte som aciduriske, fordi de kan vokse ved lavt pH (pH = 5). De homofermentative arter danner overvejende mælkesyre ved forgæring af sukkerarter. Heterofermentative arter danner foruden mælkesyre betydelige mængder af kuldioksid, ethanol og eddikesyre. Tidligere brugtes i reglen tomatagar til studier af laktobaciller. Nu lettes isolation og tælling af orale laktobaciller betydeligt ved brug af Rogosa’s Selektive Laktobacil Agar. På dette medium undertrykkes væksten af næsten alle andre orale mikroorganismer på grund af dets sure reaktion (pH = 5.4) og store indhold af forskellige salte.
Laktobaciller findes vidt udbredt i naturen (i plante-, dyre- og mælkeprodukter under forgæring, i fæces fra mange dyrearter). Hos mennesket findes laktobaciller i munden, i tarmkanalen og i vagina.
I mundhulen udgør de en karakteristisk, men talmæssigt ringe del af mikrofloraen. De er især lokaliseret i cariesangreb. I plaque udgør de kun en meget lille del af floraen (under 0.1%). Antallet er større i cariesaktiv plaque end i cariesinaktiv. På tungeryggen og de glatte slimhinder udgør laktobaciller ca. 0.3% af floraen. De fleste undersøgelser over laktobaciller i mundhulen er udført på saliva. Antallet pr. ml saliva varierer fra næsten 0 til ca. 1 million. Individer med lav sukkerindtagelse og ringe cariesaktivitet har ofte mindre end 10 000, mens individer med hyppig sukkerindtagelse og stor cariesaktivitet ofte har flere end 10 000 laktobaciller pr. ml saliva. Selv ved de høje værdier udgør laktobacillerne dog under 1% af salivas mikroorganismer. En sammenhæng mellem laktobaciltal og cariesaktivitet findes dog ikke hos alle individer. Der er stor usikkerhed forbundet med at bruge laktobaciltælling til at forudsige cariesaktivitet, da udvikling af caries er afhængig af mange forskellige faktorer. Hos patienter med meget caries kan laktobaciltællihg bruges som et pædagogisk hjælpemiddel ved kostvejledning, idet tallet falder ved indskrænkning af sukkerforbruget.
Hos gnotobiotiske rotter monoinficeret med laktobaciller opstår der kun caries i fissurer. Laktobaciller kan ikke alene danne plaque på glatte flader, og er derfor ikke en primær plaquedanner.
Veillonella kan ikke forgære kulhydrater, men udnytter forskellige organiske syrer, fx pyrodruesyre og mælkesyre under produktion af eddikesyre, propionsyre, kuldioxid og brint.
Veillonella findes hos mennesker og en række dyr i mundhulen, de øvre luftveje og i tarmkanalen. I mundhulen findes Veillonella i stort antal, idet de udgør ca. 15% af den dyrkbare flora på tungen og 6-10% af floraen i plaquen.

Eikenella corrodens og Actinobacillus actinomycetemcomitans findes begge i tandplaque. Actinobacillus A.a. udgør ofte en stor del af floraen i dybe tandkødslommer ved juvenil parodontitis JP. Nogle stammer danner leukotoksin, som kan dræbe leukocytter og monocytter. Hos monoinficerede gnotobiotiske rotter kan A.actinomycetemcomitans fremkalde hurtigt progredierende marginalt knoglesvind. A.a. kan også invadere dybt ind i gingiva og knogle.
A.a. kan forekomme ved actinomykose som ledsagebakterie til Actinomyces (deraf dens navn).
A.a. kan findes både som små ubevægelige stave og som koklignende coccobaciller, som er lejret, så de ligner morsetegn eller stjerner.
A.a. er under intens forskning, idet den ofte findes ved progressive PA-former, hvor der selv ved sparsomme mængder plaque er sket hurtigt knoglesvind.
Bakteroider findes på slimhinderne hos dyr og mennesker, i mundhulen, næsesvælgrummet, i tarmkanalen og på genital-slimhinden. De findes i særlig stort tal i tarmkanalens nederste del og i fæces. I mundhulen findes bakteroider i plaque på tænderne, i gingival plaque udgør de 10 -15% af den dyrkbare flora og i plaque længere koronalt ca. 5%. De findes også på tungeryggen, hvor de ligeledes udgør ca. 5% af floraen. De bedst kendte arter i munden kræver hæmin og menadion (vitamin K) for at vokse. De danner et sort pigment (et derivat af hæmin) , så kolonierne bliver sorte, heraf deres navn.
I ældre litteratur kaldtes alle disse pigmentdannende bakteroider for Bacteroides melaninogenicusmen der har vist sig at være mindst to arter med meget forskellige egenskaber :
B.ascacharolyticus og B.melaninogenicus.
B. asaccharolyticus (tidligereB. melaninogenicus) forgærer ikke kulhydrater men er udpræget proteolytisk og kan endog nedbryde kollagen, en evne som ikke er påvist hos andre af mundens mikroorganismer. Proteiner og aminosyrer spaltes til b1.a. organiske syrer, NH3, H2S og indol.
B. asaccharolyticus findes i gingival plaque og udgør ofte en stor del af floraen i dybe tandkødslommer ved marginal parodontitis. Den isoleres også ofte fra akutte betændelsesprocesser, i reglen sammen med andre bakteriearter (anaerob blandingsinfektion). Artsnavnet B.gingivalis er foreslået for de orale stammer af B. asaccharolyticus.
B.melaninogenicus forgærer kulhydrater under dannelsen af forskellige syrer, men er kun svagt proteolytisk. Den findes i gingival plaque ved gingivitis og marginal parodontitis.
Desuden findes i munden andre bakteroider, som ikke danner sort pigment. De kaldes ofte B.oralismen er utilstrækkeligt defineret.
Fusobakterier spalter aminosyrer under dannelse af NH3, H2S, indol, smørsyre og eddikesyre (hvilket giver pt.´s mund en ubehagelig usædvanlig dårlig lugt), men de er ikke proteolytiske. De forgærer enkelte kulhydrater, men kun med et ringe fald af pH i substratet, idet syrerne neutraliseres af NH3.
Fusobakterier findes i mundhulen, næsesvælgrummet og tarmkanalen hos mennesker og mange dyr. I mundhulen er fusobakterierne primært lokaliseret i plaque på tænderne, især i gingival plaque ved kronisk gingivitis og marginal parodontitis. Stave af fusiform morfologi er fra gammel tid beskrevet som en væsentlig del af floraen ved ulcerøse lidelser i mundhule og svælg (akut nekrotiserende gingivitis ANG og Vincent´s angina), hvilket også forklarer foetor ex ore ved ANG.
Blandt de orale arter er Fusobacterium nucleatum ret veldefineret.
Spirokætere er spiralformede, roterende og slangelignende, bøjelige og bevægelige stave med endoflageller (=aksiale filamenter), 0.1-0.5 µm tykke, 5-16 µm lange. De tyndeste ses kun i mørkefelt, fase kontrast eller elektron-mikroskop. De er obligat anaerobe og katalase-negative og forgærer kulhydrat.
De orale spirokæter findes næsten kun i plaque langs gingivalranden, hvor de udgør 1-2% af floraen. I lokaliserede områder i patologiske tandkødslommer og ved akut nekrotiserende gingivitis ANG udgør spirokæter ofte en større del af blandingsfloraen. Spirokætere er ved ANG også meget invasive og fundet dybt inde i gingival- og knoglevæv.
Spirokæter er vanskelige at dyrke og er meget lidt udforsket, så inddelingen i slægter og arter er usikker. Efter morfologiske kriterier som spiralvindingermes størrelse og tæthed samt antallet af endoflageller synes der at være flere forskellige arter i munden. Efter de nyeste dyrkningsresultater hører de til slægten Treponema og muligvis også Borrelia.
Til mundhulens mikroorganismer hører også gærsvampe. Gærsvampe er ikke årsag til PA , men indgår i forståelsen af mundhulens økosystem og kan være afgørende for forståelsen af pt.´s sygdomsbillede. Gærsvampe defineres som encellede organismer, der formerer sig ved knopskydning. Gærsvampe forekommer vidt udbredt i naturen i planter og dyr og tit under ganske specifikke økologiske forhold. Derfor kan mange forskellige arter tit isoleres fra normalfloraen, hyppigst fra mundhule, hud og fæces. Gærsvampe findes på mundslimhinden og i saliva has 30-50% af de undersøgte mennesker. De udgør en ringe del af floraen, således er antallet i saliva sjældent højt. I plaque på tænderne findes de yderst sjældent.
 Candida Albicans
Candida AlbicansOrale gærsvampe er Candida Albicans i 95% af tilfældene. Candidus : Hvid Albicantia : Hvid. I reglen er samme art ikke konstant tilstede, og kun i beskedent omfang. En undtagelse herfra er Candida Albicans , hvor bærerfrekvensen hos raske ligger omkring 25%. Under visse forhold, ikke mindst ved antibakteriel kemoterapi, ses en øgning af gærfloraen, uden at det altid nødvendigvis betyder, at pt. har en gærsvampeinfektion. Dertil kræves som regel tillige en nedsættelse af infektionsresistensen, hvor C. Albicans kan forårsage en gærsvampeinfektion, Candidose. Ved enhver Candidose må man søge efter den til grund liggende lidelse, idet der er tale om en generel eller lokalt nedsat resistens eller miljøændring.
Oral Candidose ses hos nyfødte ( Trøske ), ved svangerskab (øget hyppighed af vaginitis) og hos svækkede patienter, fx ved cancer, leukæmi eller immundefekt, fx AIDS. Candidose kan derfor ses som følgeinfektion ved behandling med cytostatika, corticosteroider, røntgenbestråling. Fremmedlegemer af enhver art kan også fremme væksten af C. Albicans*, fx katetere og proteser.
*C. Albicans er sædvanligvis følsom for Amfotericin B og Nystatin og resistensudvikling er sjælden.
Forfatter, Jakob Kihl © 2012

Gennem forståelsen af dannelsen af tand, gingiva og støttevæv opnås også en forståelse for de mekanismer der er nødvendige for opheling og regeneration af ødelagt parodontal væv.
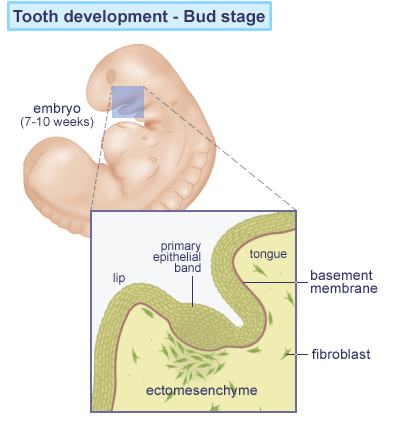
Ved tanddannelsen sker dannelsen af dentin, cement og parodontalligamentet fra de endoderme cellelag (gr. endo : indenfor + derma : hud / også kaldet inderste kimblad ). Emalje dannes fra de ektodermecellelag (gr. ektos : udenfor + derma : hud / yderste kimblad; herfra udvikles bl.a. Epidermis med hår, negle, nervesystem og tandemalje ). Allerede fra fostrets 6. uge påbegyndes tanddannelsen.
Indledning og knopstadiet “Bud stage“
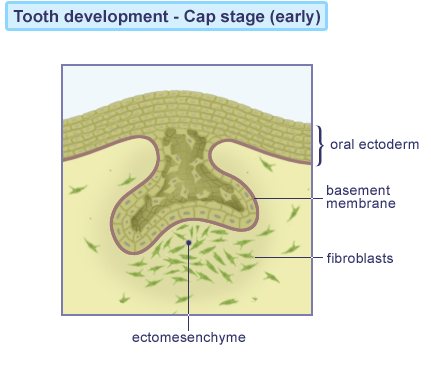
Kappestadiet “Cap stage”
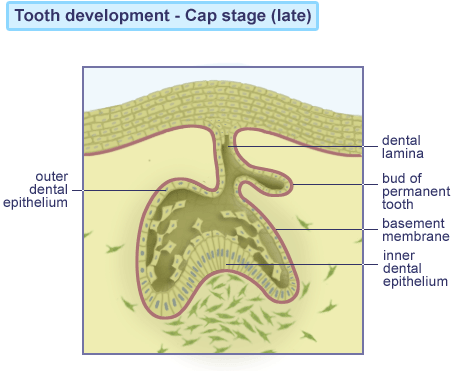
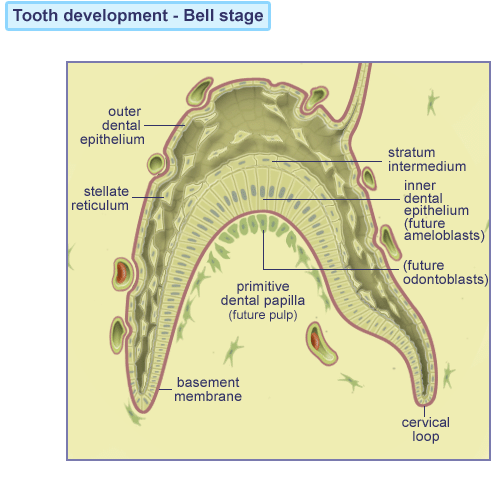
Klokkestadiet “Bell stage”
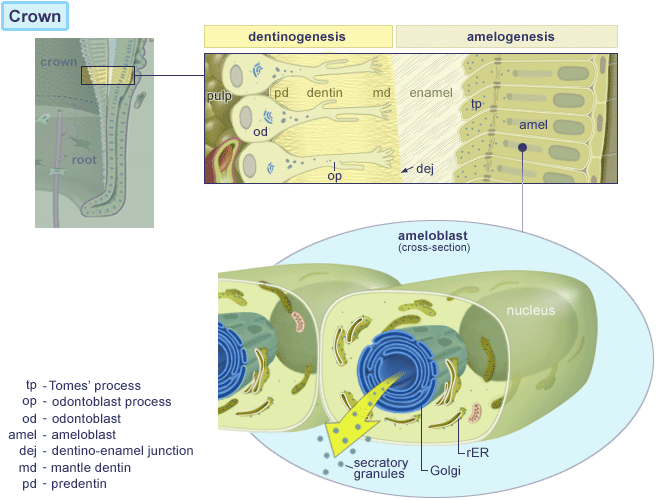
Dannelse af dentin (tandben)

Dannelse af tand emalje
Udvikling af tandroden og cement
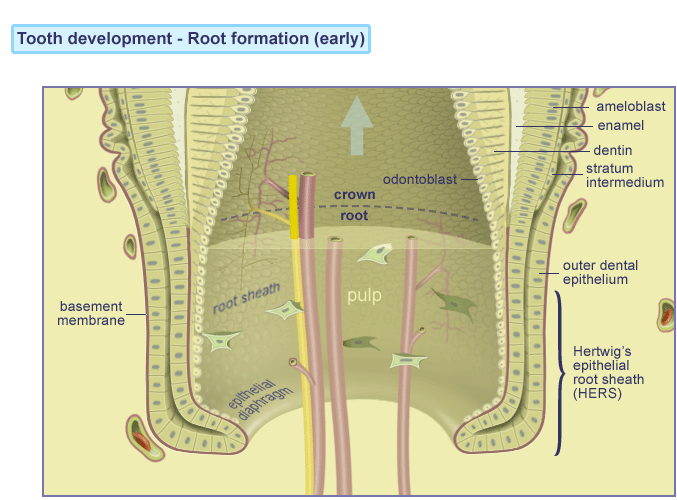
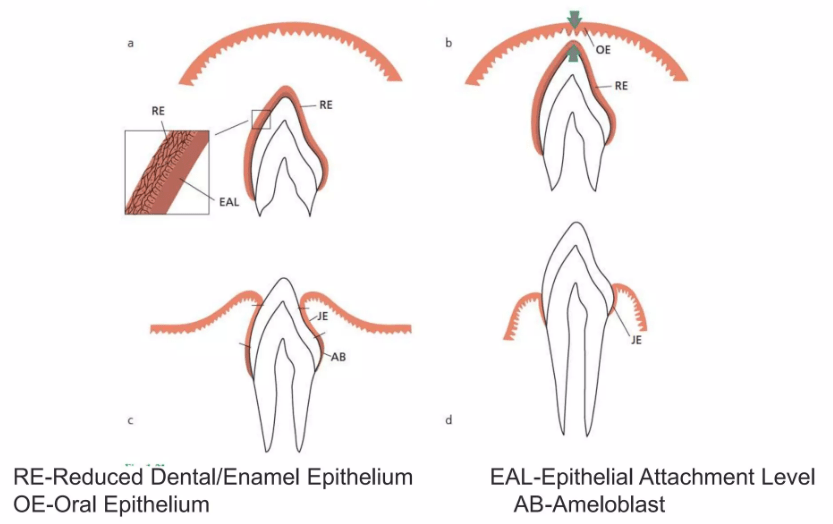
Efter formgivningen af emalje og dentin er færdig, påbegyndes dannelsen af roden ved nedvækst af de tidligere emaljedannende celler; ameloblasterne ( gl. fr. amel: emalje + gr. blastos: spire). Efter emaljedannelsen er ved at være slut, producerer ameloblaster sammen med epitelceller det Reducerede Emalje Epitel , som omgiver tandkronen fra færdigmineralisering til frembrud. Herved dannes et bånd langs grænsen mellem tandemalje og rodcement, der kaldes Hertwig´s epitheliale rodskede. Dette dobbeltlag af celler danner cementoblaster, der igen danner rodcementen, som ved indlejring af kollagen fibre er årsag til tandens ophæng ( attachment ) til alveoleknoglen.. Gingiva opnår sin morfologi ved tanderuptionen. Ved den begyndende eruption ses stor mitotisk aktivitet i det Reducerede Emalje Epitel, som omdannes til Kontakt epitel (Junctional epithelium) JE, der kun er få cellelag tykt. Kontaktepitelet JE er koronalt ( øverst mod kronen ) kun 15-20 cellelag tykt og er ved grænsen mellem tandemalje og rodcement få celler tyk. Dette er bunden af hvad der betegnes som tandkødslommen også kaldet pochen.
Forfatter, Jakob Kihl © 2013
Forfatter, Jakob Kihl © 2012
Knoglevæv og rodcement er beskrevet under alveoleknogle og rodcement.
Gingiva og parodontal ligament beskrives nedenfor.
Tandkødet (gingiva) er den del af mundslimhinden (den orale mukosa), som dækker tandhalsen kæbeknoglen omkring tænderne.
Gingiva består af en inderkerne af bindevæv (grundsubstans) og en overflade af epitel (overfladevæv). Gingiva indgår i opbygningen af mundslimhinden og udgør den del, der beskytter tandens støttevæv.
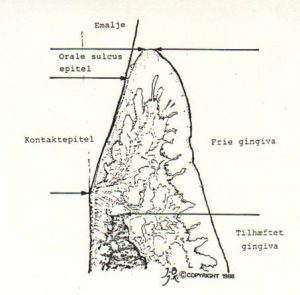
Der skelnes mellem :
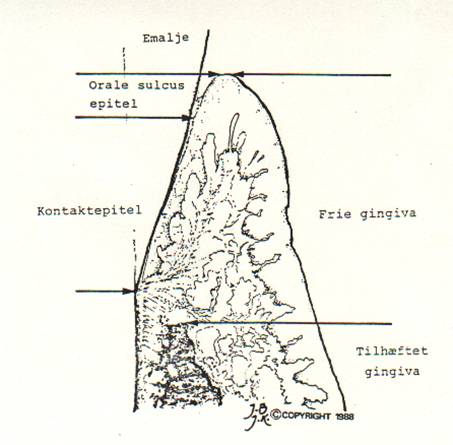
| Orale epitel | |
| Frie gingiva | Orale sulcus epitel |
| Kontakt epitel | |
| Tilhæftet gingiva |
Den frie gingiva er beklædt med henholdsvis det orale epitel, det orale sulcus epitel og kontaktepitelet.
Imellem tænderne hænger de to dele af tandkødet sammen i tandkødspapillen (interdentalpapillen). Tandkødets øverste grænse er tandkødsranden (gingivalranden). Nederst mødes tandkødet og mundslimhinden ved tandkødsgrænsen (den muko-gingivale linie). Afstanden mellem den øverste og den nederste grænse kaldes tandkødets eller gingivas bredde.
Tandkødsranden er ofte en tynd, svagt afrundet kant, der ind imod tanden danner en lille fordybning på ca. 1/2 mm (den gingivale sulcus). Når en måler (poche måler) føres ned i denne fordybning og videre langs tanden i retning af emaljecementgrænsen, kiler den sig ind mellem den frie gingiva og tandoverfladen. Den herved opståede adskillelse af tand og tandkød kaldes som regel tandkødslommen / klinisk lomme, poche. I det følgende benævnt poche.
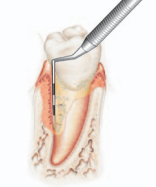
Så snart instrumentet fjernes, lukkes “lommen”/pochen til igen. I et sundt, marginalt parodontium eksisterer tandkødslommen derfor ikke som en spalte eller egentlig lomme, idet gingiva ligger i tæt kontakt med tandoverfladen ‑ men den opstår, når gingiva presses væk fra tandoverfladen som beskrevet.
På færdigt frembrudte tænder ligger tandkødslommens bund ved emaljecementgrænsen, mens tandkødslommen på tandemaljen ligger 1‑2 mm fra bunden af tandkødslommen. Tandkødslommens dybde bliver herved det samme som den frie gingivas bredde som regel 1‑2 mm.
Tandkødspapillerne udfylder normalt tandmellemrummene. Papillens form afhænger af tandkronens bredde og kontaktforholdene.
Tandkødspapillernes funktion er at forhindre mad i at sætte sig mellem tænderne.
Den fæstede gingiva er en del af gingiva, som ligger mellem den frie gingiva og tandkødsgrænsen (muko‑gingival‑linien). Tandkødsgrænsen kan findes ud fra disse 3 forskelle på tandkød og mundslimhinde: Tandkødet ligger fast og kan ikke bevæges, mens mundslimhinden er løs og kan bevæges. Tandkødets overflade er ujævn som en appelsinskal, mens mundslimhinden er glat.
Tandkødet er lyserødt, mens mundslimhinden er mørkerød. Undtaget herfra er ganen, hvor gingiva uden overgang fortsætter i ganens slimhinden.
Betegnelsen fæstet hentyder til, at gingiva her er fast bundet til rodcement og alveoleknogle ved hjælp af bindevævsfibre. Den fæstede gingiva hæfter sig til rodcementen og alveoleknoglen.
Dette adskiller den ikke alene fra den frie gingiva, men også fra den øvrige mundslimhinde, som er løst bundet og forskydelig i forhold til sit underlag. Bredden af den fæstede gingiva varierer fra 1 til 9 mm. Den bredeste gingiva finder man tit facialt for overkæbens incisiver og den smalleste gingiva ses tit facialt for underkæbens præmolarer.
Der synes at være en tendens til, at bredden øges med alderen.
Gingivas væv består som nævnt af epitel og bindevæv (grundsubstans). Bindevævet i gingiva består af en række forskellige celler, kar og nerver lejret i en rigelig grundsubstans. Almindeligst blandt cellerne er fibroblasten, som producerer bindevævets fibre samt vigtige komponenter af grundsubstansen.
Af andre celletyper forekommer i små mængder lymfocytter, plasmaceller, makrofager, mastceller og leukocytter ‑ celler, hvis tilstedeværelse især forbindes med vævets forsvarsreaktioner, men som altid forefindes.
Grundstubstansen udgør det miljø, cellerne lever i, og som transporterer nærings‑ og affaldsstoffer til og fra cellerne.

Fibrene er bundter af tynde tråde, som i forskellig tykkelse og med forskellige forløb danner et tæt trådnet i gingivas bindevæv.
Gingivas bindevæv er med sine fibersystemer med til at binde den fæstede gingiva stramt til underlaget, dvs. alveoleknoglen og rodcementen. Desuden holdes den frie gingiva stramt omkring og tæt ind til tandoverfladen, så tandkødslommen holdes lukket.
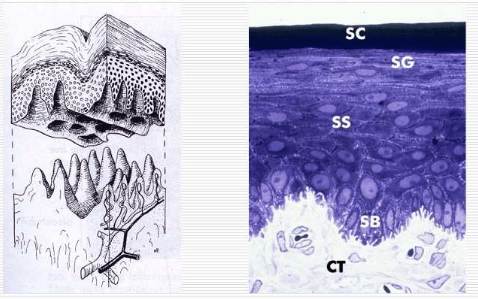
Epitelet beklæder gingivas overflade, hvor man finder to forskellige slags, det orale epitel og kontaktepitelet.
Det orale epitel er af typen flerlaget, forhornet pladeepitel. Det består af adskillige lag af tætliggende epitelceller, som nærmest bindevævet er høje og rørformede, mens cellerne nærmere overfladen afflades og i de yderste lag udviskes til et avitalt hornlag. Imellem epitelcellerne kan der optræde enkelt andre celler, fx pigmentceller, hvis tilstedeværelse gør gingiva mørkere.
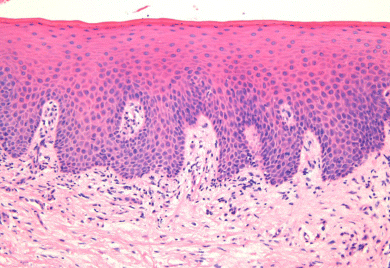
Grænsen mellem epitel og underliggende bindevæv er tydelig og har et karakteristisk, bugtet forløb, hvor epitellagene griber ind i bindevævspapiller. Det er fra epitelcellerne ind imod bindevævet, at epitelet konstant er under fornyelse. Det sker ved celledeling, hvorefter de nydannede celler langsomt bevæger sig gennem epitelet mod overfladen. Undervejs ændrer de form efter det lag, de passerer. De bliver stadig fladere ud imod overfladen, hvor de til sidst afstødes som forhornede cellerester. Det varer ca. 1 måned for epitelcellen at nå fra bindevævsgrænsen til afstødningen fra epitelets overflade. Det er karakteristisk for det orale epitel, at cellerne ligger tæt og fast sammen med kun en ringe mængde substans imellem. Desuden er epitelet ved bindevævsgrænsen fast sammenvokset med et underliggende bindevæv.
Gingivas epitel beklæder støttevævene, så udsivning af vævsvæske forhindres, og yder samtidig støttevævene beskyttelse mod ydre traumer og irritamenter. Mundhuleepitelet er således med sin tykkelse og forhorning tilpasset dette områdes særlige mekaniske påvirkninger i forbindelse med tyggeprocessen.
Kontaktepitelet er et flerlaget pladeepitel med få cellelag. Basalcellelaget består af kubiske celler, mens de øvrige celler er polygonale eller affladede. Cellerne har ovale nucleoli, dominerende Golgi-apparat, udvidede cisterner i granulært endoplasmatisk retikulum og få cytoplasma filamenter. Der ses et mindre antal desmosomer og større intercellular rum end i andet epitel. Dette menes at være en af årsagerne til, at kontaktepitelet er mere permeabelt end organismens øvrige epiteler.
Kontaktepitelet hæfter både til tand og bindevæv med strukturelt samme mekanisme. Strukturen mellem tand og kontaktepitel benævnes intern basal lamina ( IBL). Strukturen mellem kontaktepitel og bindevæv kaldes ekstern basal lamina (EBL). Kontaktepitelet dækker det meste af den cervikale emalje, men kan også prolifere i apikal retning.
Kontaktepitelet / Junctional epithelium JE er et flerlaget, uforhornet pladeepitel. Det er tyndere end det orale epitel, og ved emaljecementgrænsen, hvor kontaktepitelet ender, består det kun af nogle få lag celler, omkring 10-15.
Grænsen mellem epitel og bindevæv forløber her lige. Cellerne i de overfladiske lag er uforhornede og ligger tæt ind til tandens emaljeoverflade. Den nøjagtige beskaffenhed af forbindelsen mellem epitel og emaljeoverflade, kaldet epitelfæstet/kontaktepitelet, er delvis uafklaret. Epitelfæstet synes dog at minde om den forbindelse, der ved bindevævsgrænsen findes mellem epitel og bindevæv. Det vil sige, at kontaktepitelet ikke kun ligger tæt ind til tandoverfladen, men også er strukturelt forbundet med denne. Kontaktepitelet opstår i forbindelse med tændernes frembrud. Når denne færdigdannede tandkrone nærmer sig overfladen, vil resterne af det emaljedannede epitel, som stadig ligger rundt om kronen, smelte sammen med mundhulens epitel. I løbet af selve frembruddet vil emaljeepitelet efterhånden reduceres og omdannes til kontaktepitel.
Den specielle udformning af forbindelsen mellem tand og gingiva må ses som resultat af de særlige omstændigheder, tændernes tilstedeværelse skaber. Tænderne bryder mundhulens slimhindedække, og det kræver en forsegling af brudstederne til at beskytte de underliggende væv.

Se nærmere om dannelse af tand og støttevæv : /dannelsen-af-tand-gingiva-og-stoettevaev-hos-foster/
Epitelfæstet danner en sådan forsegling. Vendt indad mod tandoverfladen er kontaktepitelet ikke udsat for større mekaniske påvirkninger, hvilket kan forklare, at det er tyndt og uforhornet. Samtidig er det imidlertid mere gennemtrængeligt, såvel fra tandkødslommen som fra det underliggende bindevæv.
Dette kan på den ene side opfattes som et øget beredskab over for indtrængende irritamenter, på den anden side er der også tale om en øget modtagelighed, idet beskadigende stoffer udefra kan trænge igennem epitelet fra tandkødslommen.
Kontaktepitelets fornyelse sker ved celledeling langs bindevævsgrænsen. Herfra bevæger cellerne sig mod indgangen til tandkødslommen, hvor de afstødes. Kontaktepitelets celler ligger knap så tæt sammen som det orale epitels celler. Dette, sammenholdt med at kontaktepitelet er tyndt og uforhornet, kan forklare, at det kun varer ca. 1 uge for epitelcellen at nå fra bindevævsgrænsen til overfladen.
Det orale epitel er tykt og forhornet og derfor uigennemtrængeligt og velegnet til at modstå mekaniske påvirkninger. Med kontaktepitelet forholder det sig anderledes. Det er tyndt, uforhornet og har en mere åben struktur i kraft af sine bredere intercellularrum. Herved bliver det lettere at passere for skadelige stoffer ude fra. Men samtidig rummer det også særlige forholdsregler. Kontaktepitelets fornyelsestid er meget kort. Den åbne struktur gør, at hvide blodlegemer (neutrofile granulocytter) fra det underliggende bindevæv kan vandre igennem epitelet og tilintetgøre (fagocyttere) fx indtrængende bakterier. På samme måde og med samme formål kan vævsvæske (eksudat) sive fra bindevævet ud til kontaktepitelets overflade og fx fjerne antigener fra kontaktepitelet ved hjælp af sit indhold af antistoffer. Væsken kaldes som regel gingivalvæsken / ginigivaleksudat. Den hører strengt taget til betændelsesreaktionerne ved parodontitis, hvor gingivalvæsken secerneres i så store mængder at eksudatet i pochen udskiftes op til 40 X timen, men nævnes også her, da den i små mængder forekommer så at sige altid.

Parodontal ligamentet / rodhinde, parodontalmembran består af celler i et netværk af kollagene fibre med indlejrede blodkar og nerver. Fibrene hæfter mellem tand og knogle.

Parodontalligamentet er et tyndt lag af bindevæv, som omslutter tændernes rødder og fæster dem til alveoleknoglen.
Parodontalligamentet ligger således indskudt mellem knoglevæv og rodcement.
Parodontalligamentet er uden overgang sammenhængende med gingivas bindevæv.
Parodontalligamentet er ca. 1/4 mm tyk, tyndest omtrent midtrods og tykkest nær rodspidsen og nær knoglekanten.
Forskellen er dog så lille, at den ved en almindelig klinisk undersøgelse, fx røntgenundersøgelse, ikke kan måles.
Parodontalligamentets væv ligner bindevævet i gingiva. Parodontalligamentets celler er de samme, men fibroblasterne er langt de talrigeste, og langs rodcementen forekommer desuden cementoblaster (cementdannende celler) og langs alveoleknoglen osteoklaster (knoglenedbrydende celler) og osteoblaster (knogledannende celler).
Fibrene er et dominerende element i parodontal ligamentet. Deres forløb og eftergivenhed gør det muligt for tanden at bevæge sig i alveolen. De omfatter dels uorganiserede fibre, som forløber i forskellige retninger og findes spredt i hele parodontalligamentetog dels organiserede fibre, som i kraftige, tætte bundter forbinder rodcementen med alveoleknoglen.
De enkelte fibre dannes ved, at fibre indlejret i rodcementen vokser sammen med fibre, der udgår fra alveoleknoglen.

De færdige fibres forløb tværs gennem parodontalligamentet er svagt bølget, så de kan strækkes i forbindelse med tandens bevægelse
Den dominerende celle i parodontal ligamentet er fibroblasten :

Parontalligamentfibrene udgør sammen med de dentogingivale fibre det, man normalt kalder tandens fæste. Herved forstås med andre ord fibre, som fæster sig i rodcementen. Med betegnelsen fæstetab kan man følgelig angive det rodareal, hvor et sådant fæste er gået tabt.
Tændernes bevægelighed (den fysiologiske mobilitet) er den bevægelighed, som tænder med sunde parodontalforhold udviser normale tyggeflade belastninger, fx under tygning.

Størrelsen af bevægelsen er mindre end ca. 1/4 mm, så den kan vanskeligt iagttages klinisk. Tyggetrykkets størrelse og retning på de enkelte tænder afhænger af bidforholdene. Normalt ligger kraftpåvirkningerne inden for et område, som begrænses af retninger parallelt med tandens akse og vinkelret på tandens akse.
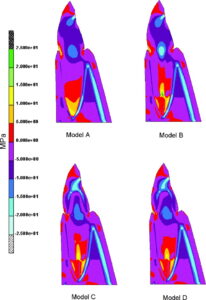
Fysiologiske belastninger af tænder, dvs. kraftpåvirkninger som ikke overskrider de parodontale vævs kapacitet, opfanges og fordeles i parodontalligamentet, der herved får funktion som tandens “stødpude”. Belastningen afstedkommer forskellige, forbigående forandringer i parodontalligamentet. Når tyggetrykket via de hårde tandvæv overføres til parodontalligamentet, opstår der her karakteristiske tryk og trækzoner, idet tanden bevæger sig og derved ændrer stilling i alveolen. Når belastningen ophører, vender tanden tilbage til sin oprindelige position.
Disse og andre funktioner er bestemmende for parodontalligamentets struktur og kvalitet. Fibrenes mængde og organisering er således afhængig af, at parontalligamentvævet stimuleres under tandens funktion.
Når det er tilfældet, afpasses fibrenes retning og mængde nøje efter de okklusale belastningers størrelse og retning. Udebliver stimulering af parodontalligamentet, fx efter tab af tandens antagonist(modsatte tand), mindskes fibermængden, og fibrene bliver i højere grad uorganiserede.
I rodhinden, særligt den del der vender mod alveoleknoglen, foregår der uophørligt ombygningsprocesser. Fx slides tænderne med årene ved kontaktpunkterne, uden at kontakten med nabotænderne bliver mindre tæt af den grund. Som kompensation for sliddet sker der en langsom mesialvandring i hele tandsættet, tilvejebragt ved ombygningsprocesser i rodhinde og tilgrænsende alveoleknogle. Lignende tilpasning ses i forbindelse med tandtab eller ændringer i belastningen af de enkelte tænder.
I trykzonen reagerer parontalligamentvævet på belastningen ved en sammenfoldning af de organiserede fibre og en sammenpresning af kar og grundsubstans, hvorved blod og vævsvæske presses bort fra trykstedet.
I trækzonen reagerer vævet omvendt, idet fibrene strækkes, og der sker en udlignende tilstrømning af blod og vævsvæske. Fordelingen af træk og trykzoner afhænger af belastningsretningen, således at fx tryk parallelt med tandens længdeakse koncentrerer trykzonen i det apikale område, mens trækzonen fordeles jævnt i resten af parodontalligamentet.
Parodontalligamentets funktioner kan herefter sammenfattes således:
1. Forankring af tanden.
Parodontalligamentets fibersystemer fæstner tanden til alveolen, samtidig med at parontalligamentvævet er velegnet til at opfange og fordele okklusale belastninger.
2. Vævsfornyelse.
Vævsfornyelsen af Parodontalligamentets væv er først og fremmest knyttet til fibroblaster, som til stadighed danner nye kollagene fibre. Parodontalligamentet har stor tilpasningsevne over for ændringer i omgivelserne. Sådanne ombygningsprocesser skyldes aktivitet fra osteoklaster, osteoblaster samt i mindre udstrækning fra cementoblaster.
3. Sanseregistrering.
Parodontalligamentet er rig på nerveenheder, som modtager berørings, tryk og smerteimpulser. Balancen mellem de okklusale belastninger og parodontalligamentets reaktion herpå styres ad nervebaner, som omsætter de fintmærkende nerveender i parodontalligamentets registreringer til impulser, der kontrollerer tyggemuskel funktionen.
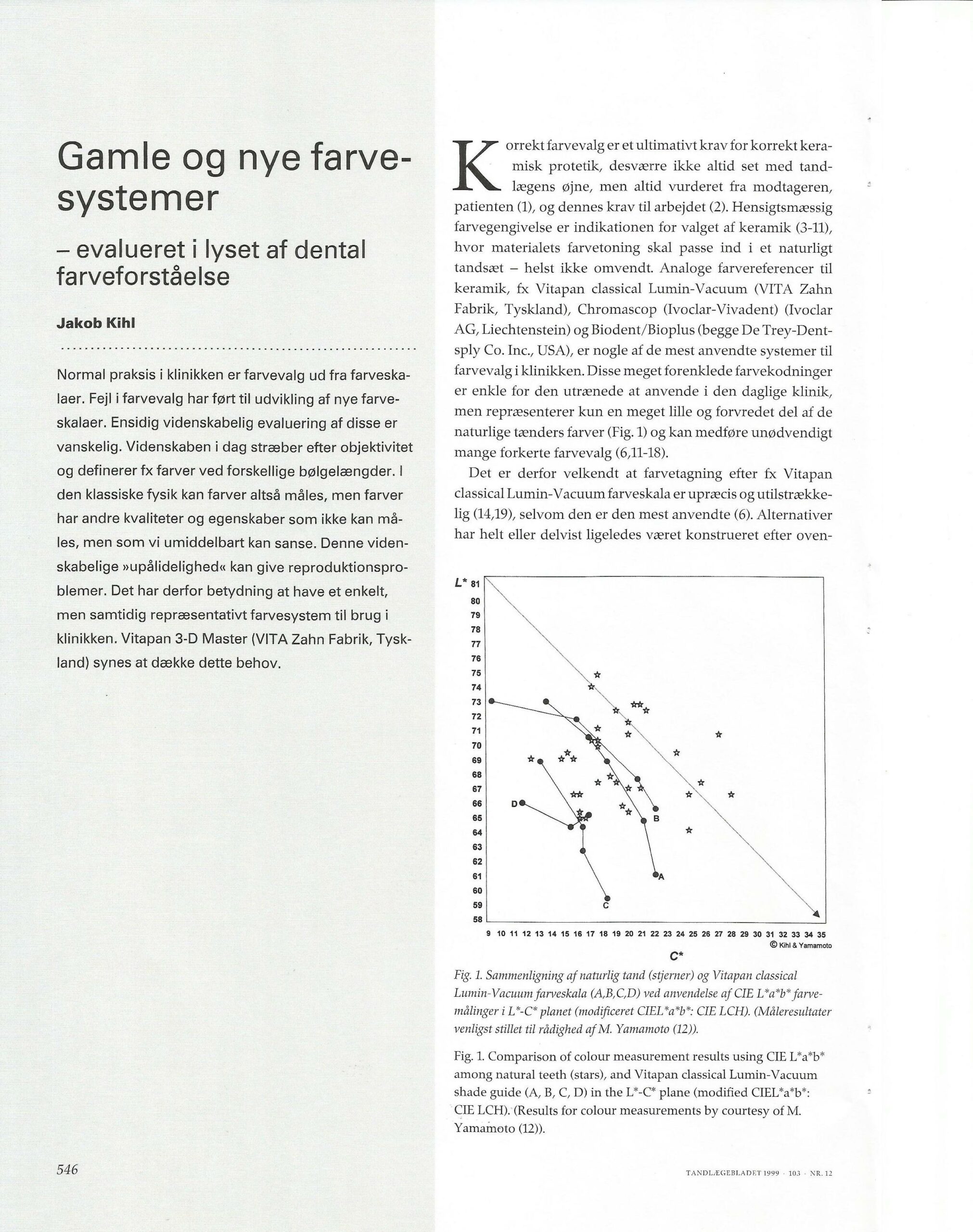
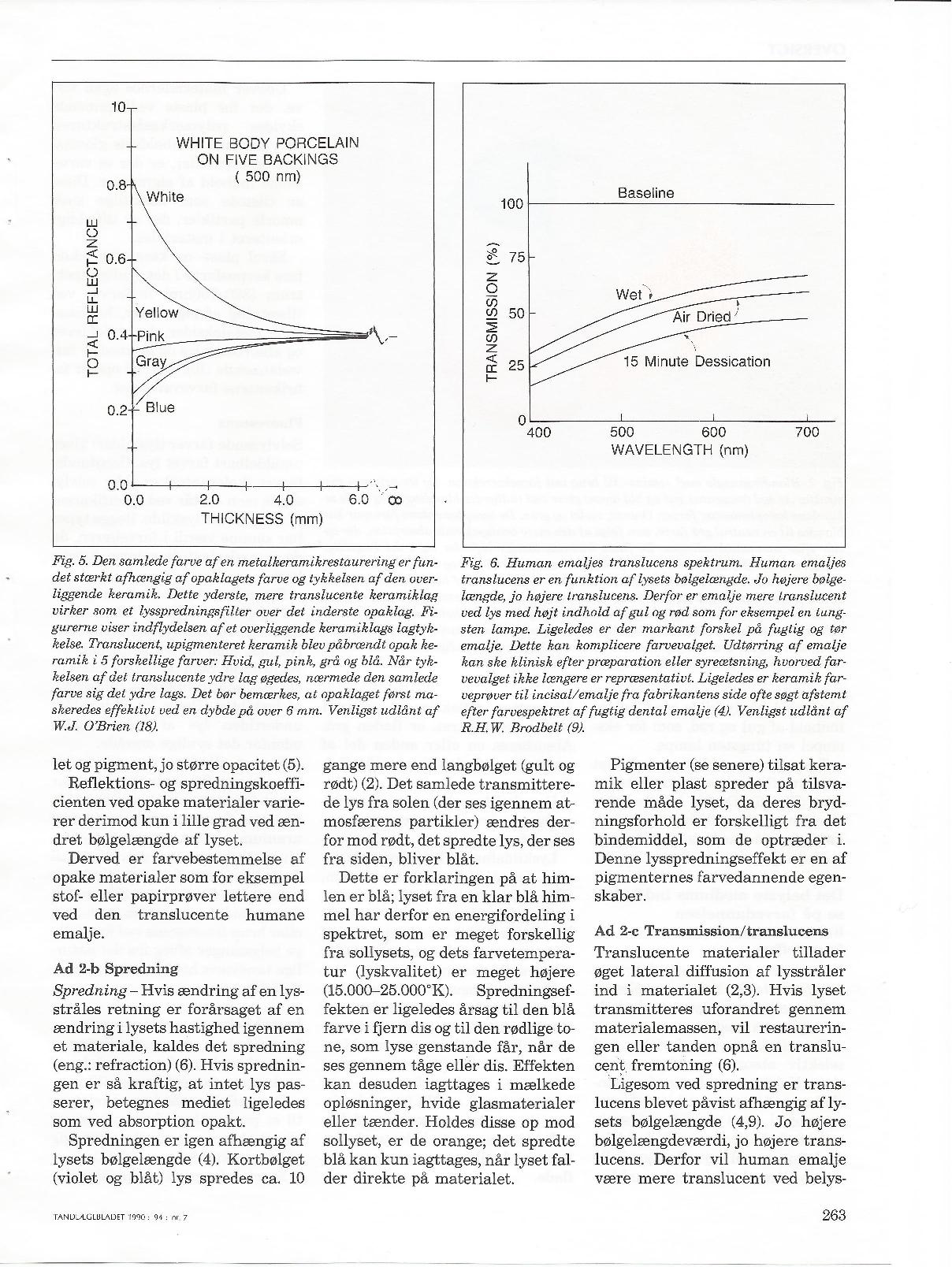
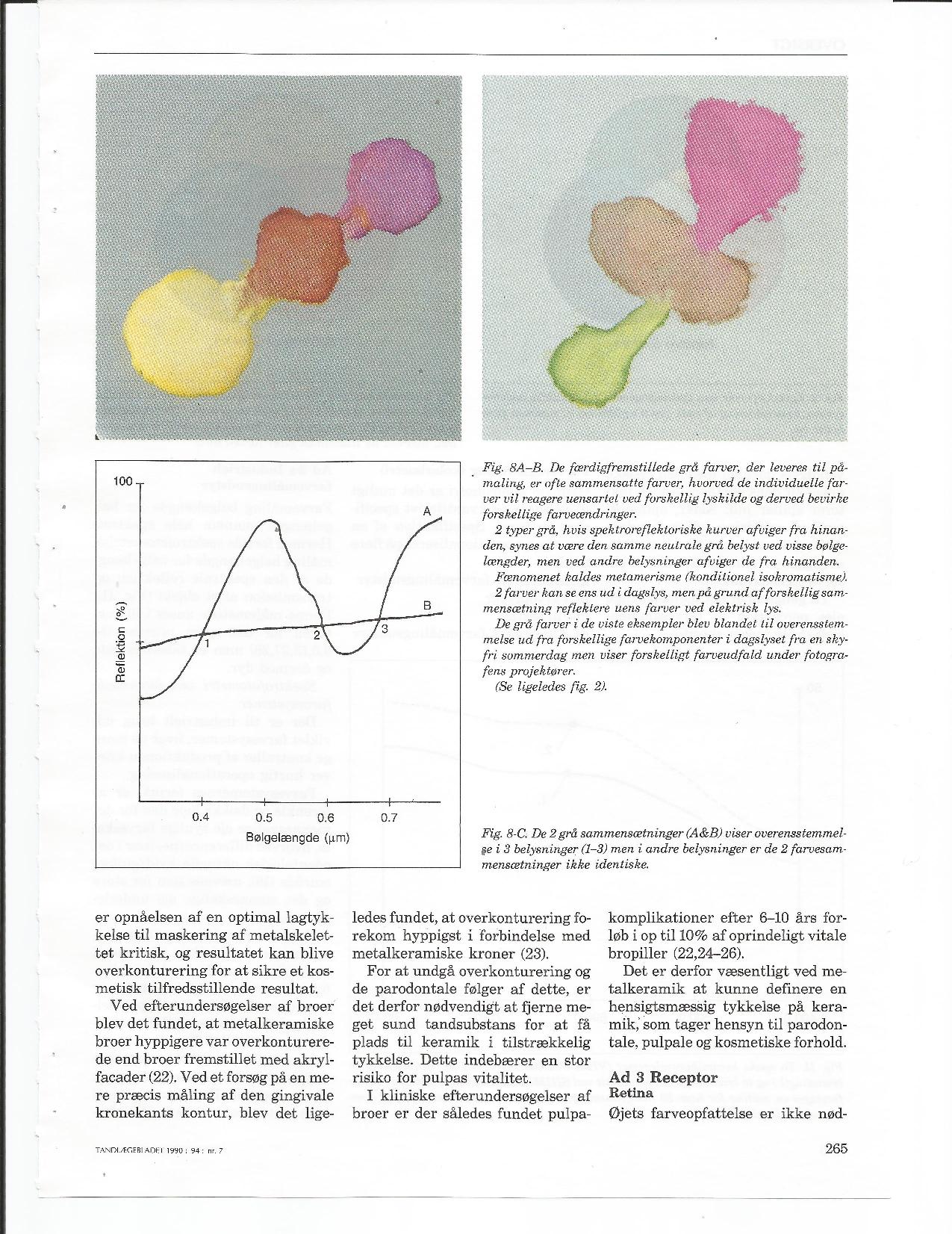
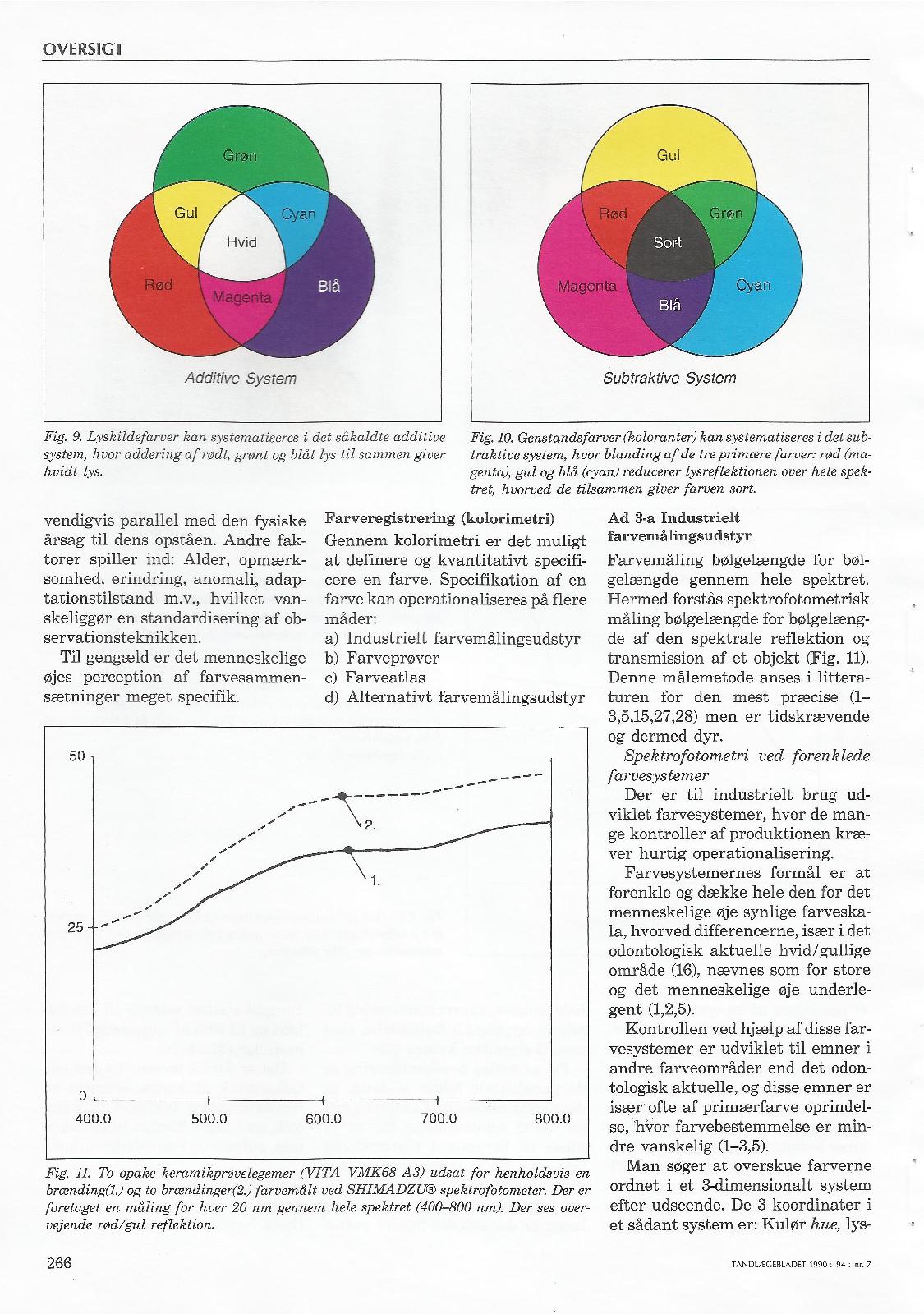
Gamle og nye farvesystemer – evalueret i lyset af dental farveforståelse.
Forfatter: Tandlæge Jakob Kihl
Tandlægebladet 1999 – 103 – NR.12



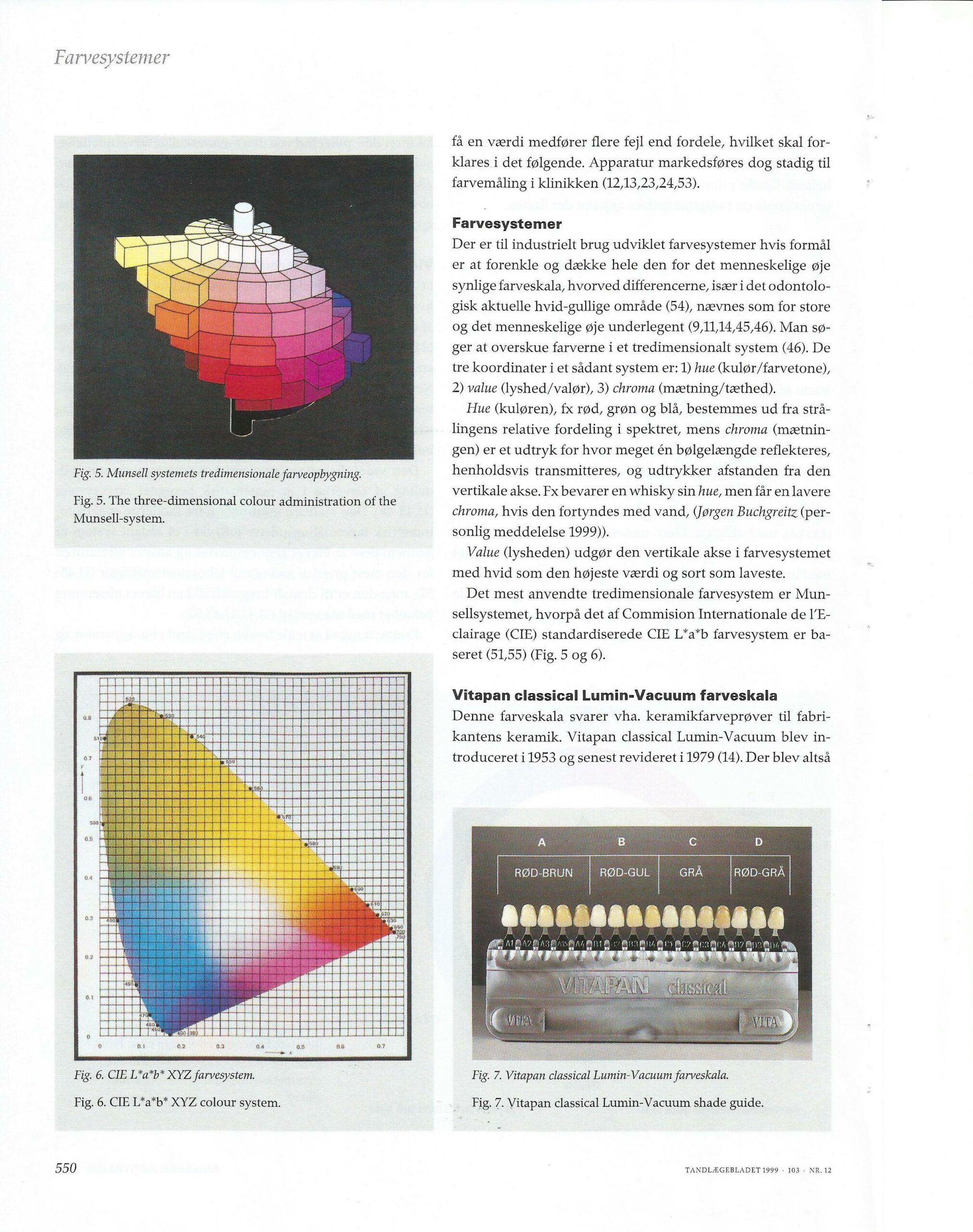





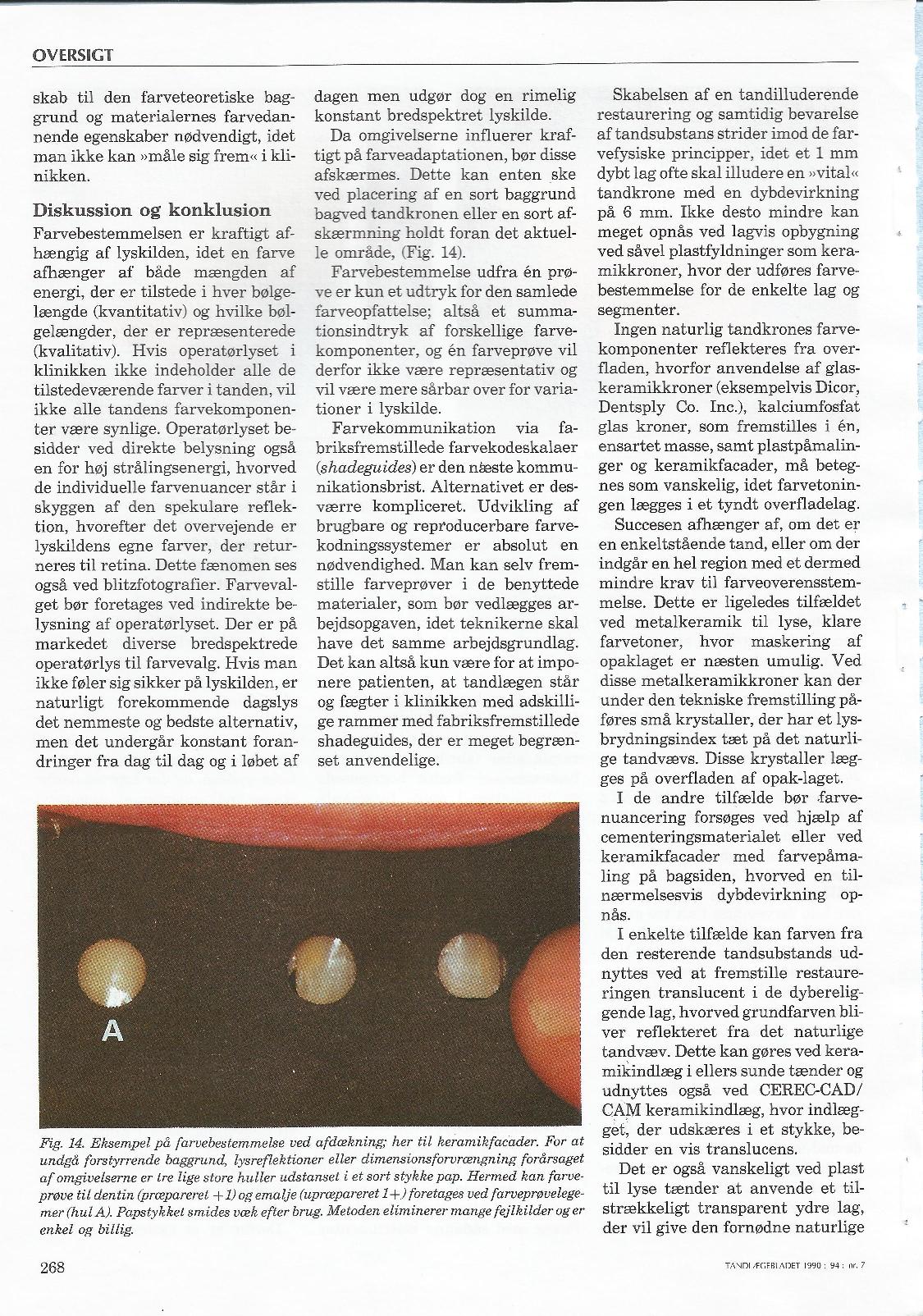
Tandlægebladet 1990 nr. 7 – side 261-269
Forfatter: Tandlæge Jakob Kihl





Nej tak, jeg vil gerne være anonymNedenstående liste viser de cookies der benyttes på dette website.
| Cookie | Beskrivelse |
|---|---|
| _pinterest_cm | Bliver brugt af Pinterest. Den sender oplysninger om deres brugere, om det materiale deres bruger vælger at dele, om ophavsret og fra hvilket domæne brugerens oplysning er hentet fra. Læs mere på pinterest: https://policy.pinterest.com/ |
| cookielawinfo-checkbox-necessary | ID af cookie bruger indstillinger (No=Vis kun nødvendige cookies, Yes=Cookie accept) |
| cookielawinfo-checkbox-non-necessary | Gemmer cookie bruger accept eller afvisninger |
| PHPSESSID | Cookie genereret af applikationer baseret på PHP-sproget. Dette er en generel brugeridentifikator, der bruges til at vedligeholde brugersessionvariablerne. Det er normalt et tilfældigt genereret nummer, hvordan det bruges kan være specifikt for webstedet, men et godt eksempel er at opretholde en logget ind-status for en bruger mellem sider. Denne cookie er MEGET nødvendig, uden denne, kan en browser ikke oversætte et websted. |
| viewed_cookie_policy | Fortæller om Cookie policy er læst |
| wfwaf-authcookie-6609.... | Denne cookie giver vores firewall mulighed for at registrere indloggede brugere og give dem øget adgang. Det giver også vores firewall mulighed for at registrere ikke-loggede brugere og begrænse deres adgang til sikre områder. Cookien lader firewall'en vide, hvilket adgangsniveau en besøgende har for at hjælpe firewall med at tage smarte beslutninger om, hvem de skal tillade, hvem der skal begrænses og hvem de skal blokere. |
| wp_google_apps_login | Hvis du kan se denne cookie i din browser oversigt, så kan du logge ind på siden. Hvis du ikke kan se den betyder det at du ikke har fået en nøgle til hoveddøren ;-) |
| wp_sec_6f1d67d68afcc0a85d | Sikkerheds cookie der beskytter os imod hacking, spyware og worms |
| WP_test_cookie | En cookie der tester de andre cookies |
| wp-settings-1 | Funktionel cookie, benyttes af websitet |