Bakteriebelægninger på tænder, fyldninger og proteser i mundhulen
Uddrag fra Kompendium i Parodontologi, SKT, Københavns Universitet

-Billedet viser en tandbørste i færd med at fjerne plaque
Mundhule = økosystem
Økologi er læren om de indbyrdes relationer mellem levende organismer og om organismernes forhold til det omgivende miljø. I et bestemt miljø finder man i reglen en mikroflora, hvis medlemmer er i balance med hverandre og deres omgivelser (økosystem). Den konstante mikroflora er ofte karakteristisk for den pågældende lokalisation.
Menneskets mundhule kan betragtes som et sådant økosystem omfattende en meget talrig og kompliceret mikroflora tilpasset det specielle miljø Mikroorganismerne vokser på overfladerne af tænder og slimhinder, idet de har en særlig evne til at hænge fast, så de ikke skylles væk med spyttet. Deres næring stammer fra spyttet, menneskets kost og fra gingival eksudat.
Økosystem = udsnit af naturen, hvori systemets enkelte dele:
1. Makrodel
2. Mikrodel
3. Omgivende miljø
er i balance / tilpasset det specielle miljø
Mundhulen består af mange lokalisationer / økosystemer
Økologiske nicher
Miljøet og dermed mikrofloraen er nem1ig forskelligt på de glatte slimhinder, på tungeryggen, i sunde og patologiske tandkødslommer, på tændernes glatte flader, i tændernes fissurer og i eventuelle cariesangreb. Disse steder udgør altså forskellige økosystemer eller økologiske nicher. Salivas mikroflora er en varierende blanding af mikroorganismer fra de forskellige områder.
Miljøforskelle
Så vidt man kan se ud fra vort mangelfulde kendskab til mundfloraen, har alle mennesker stort set de samme arter af mikroorganismer i munden. Forskelle i levevis og oralt miljø betinger dog store variationer i antal og i mængdeforholdet mellem arterne. Sådanne kvantitative variationer ses ikke blot fra en civilisation til en anden, men også fra individ til individ og endog hos samme individ til forskellige tider.
Mundfloraens etablering og udvikling
Fosterets mundhule er normalt steril, men erhvervelsen af en mundflora starter umiddelbart efter (eventuelt under) fødslen ved at barnet kommer i kontakt med moderen, andre personer og omgivelserne iøvrigt. Mange forskellige mikroorganismer kommer derved ind i barnets mundhule, men de fleste optræder kun inkonstant (transient), fordi miljøet ikke er gunstigt for deres permanente etablering (implantation). Kun visse arter etableres permanent, fordi de er tilpasset de orale miljøer og egnede til at kolonisere slimhinder og tænder. Disse organismer kommer i stor udstrækning fra moderens og eventuelt andre menneskers mundflora, mens mikroorganismer fra fx hud, føde, tøj og luften kun optræder inkonstant i munden.
I løbet af barndommen og senere i livet sker der ændringer i det orale miljø fx ved kostændringer, tandfrembrud, tandtab, udvikling af caries og marginale parodontopatier. Herved ændrer også mikrofloraen sig.
I de første levemåneder er mundfloraen stærkt domineret af streptokokker og indeholder kun små og varierende mængder af andre bakterier. Denne tidligste mikroflora i den tandløse mund er altså hovedsagelig fakultativt anaerob. Tilstedeværelsen af den obligat anaerobe bakterier viser dog, at de fakultative mikroorganismer skaber et anaerobt miljø på tungeryggen, hvor størstedelen af mikrofloraen er lokaliseret i den tandløse mund.
Efterhånden som tænderne bryder frem koloniseres de af mikroorganismer, især i fissurerne, langs gingivalranden og ofte tillige i cariesangreb. Disse økosystemer afviger fra tungens, og i løbet af barndommen bliver mundfloraen stadig mere kompleks. Selv om streptokokker fortsat dominerer, findes tillige stigende antal af actinomyces, laktobaciller, veillonella, bakteroider, fusobakterier, spirokæter og mange andre. Floraen er en blanding af fakultativt og obligat anaerobe mikroorganismer med et stigende indhold af obligat anaerobe, idet der hersker anaerobe forhold i de vigtigste økosystemer. Bacteroides melaninogenicus og spirokæter har man kun fundet hos en del af de undersøgte børn før skolealderen. Disse organismer er lokaliseret i tandkødslommerne og findes ikke hos alle før omkring puberteten. Hertil kommer i løbet af de første leveår de organismer, som især findes i plaque på tænderne, nemlig Streptococcus sanguis & S. mutans og en lang række obligat anaerobe bakterier.
Ved ekstraktion af samtlige tænder falder det totale antal mikroorganismer i munden stærkt, og især den anaerobe del af floraen aftager. Efter indsætning af proteser bliver floraen atter stort set som hos personer med tænder, idet bakterierne vokser på proteserne. Dog mangler gingival randens specielle mikroflora hos patienter med helprotese.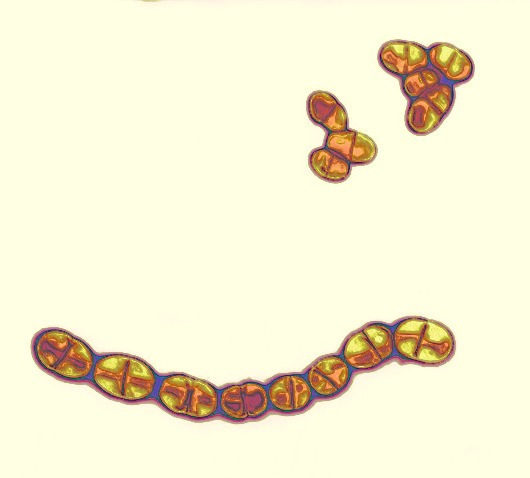
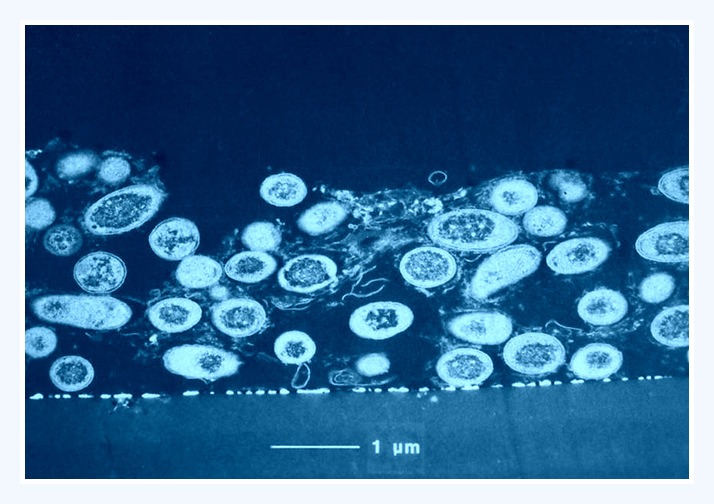
-Billederne viser Streptococcus Mutans
Tændernes betydning for mundfloraen er dog stærkt afhængig af individets mundhygiejne, idet en virkelig effektiv mundhygiejne hindrer ophobning af mikroorganismer på tændernes glatte flader.
Miljøet i mundhulen
Saliva ( Spyt )
Saliva er en vigtig faktor i det orale miljø, og individuelle forskelle i salivas sammensætning og mængde er sandsynligvis medansvarlige for variationer i oral mikroflora, cariesaktivitet og tandstensdannelse.
Kosten
Da den føde, vi spiser, sammen med saliva og ginvival eksudat tjener som substrat for mundhulens mikroflora, er det naturligt, at mikrofloraens sammensætning og biokemiske aktivitet afhænger af kostens sammensætning og måltidernes hyppighed. Man ved endnu meget lidt om disse forhold. Det er dog kendt, at personer, som ofte spiser sukker har øget antal af de mikroorganismer, som kræver forgærbart kulhydrat i deres energistofskifte (fx laktobaciller). Hyppig indtagelse af specielt sakkarose (sukrose) giver en forøgelse af Streptococcus mutans i tandplaque, fordi disse bakterier ud fra sakkarose producerer ekstracellulære polysakkarider ved hjælp af hvilke de kan hænge fast på tandoverfladerne. Det har også vist sig, at implantation af S. mutans i munden på dyr og mennesker er vanskelig, medmindre man sørger for tilførsel af sakkarose, som fremmer etableringen.
Kulhydrater i kosten:
| Polysakkarider : | stivelse |
| sukkerarter : Monosakkarider : | glukose fruktose |
| sukkerarter : Disakkarider : | maltose sakkarose laktose |
Diffusionsforholdene i plaquen er af stor vigtighed. Små substratmolekyler som fx mono- og disakkarider og aminosyrer diffunderer let ind i plaquen og optages og omsættes hurtigt af bakterierne. Derimod kan store substratmolekyler (fx stivelse og proteiner) kun vanskeligt diffundere ind i plaquens dybere lag. Bakteriernes stofskifteprodukter (fx syrer) ophobes i plaquen i ret høje koncentrationer, fordi de diffunderer ud af plaquen langsommere end de produceres.
Ilt, som diffunderer ind i plaquen, forbruges omgående, og bakteriernes samlede stofskifteaktivitet skaber et anaerobt miljø. Stofomsætningen i plaquen er derfor langt overvejende anaerob.
Ekstracellulære bakterieprodukter
Desuden indgår forskellige makromolekyler produceret af bakterielle enzymer. Der er tale om enzymer, der enten er lokaliseret på cellernes overflade eller er udskilt af cellerne, så de findes i den intermikrobielle substans. Derfor findes produkterne dels som en kapselsubstans omkring bakterierne og dels mere diffust fordelt i den intermikrobielle substans. Antagelig findes der mange forskellige sådanne ekstracellulære bakterieprodukter i plaquen.
Ekstracellulære polysakkarider EPS
Bedst kendt er de specielle ekstracellulære polysakkarider EPS, som visse bakterier danner ud fra sakkarose i kosten. Streptococcus sanguis og Streptococcus mutans producerer således forskellige EPS ud fra sakkarose. En type EPS kaldes mutan, fordi den dannes af S. mutans. Mutan-EPS er uopløseligt i vand, og findes bundet til cellevæggen hos S. mutans og er ansvarlig for aggregation af denne bakterie, når den modtager sakkarose som substrat.
Hver bakteriestamme danner i reglen flere typer polysakkarid. Plaquens bakterier kan kun i ringe grad nedbryde EPS, så de ophobes i den intermikrobielle substans ved hyppig sukkerindtagelse. Herved øges plaquens volumen, fordi der bliver mere intermikrobiel substans, og fordi flere bakterier bliver klistret fast.
Energidepoter
På lignende måde dannes ud fra sakkarose polysakkarider, der kan nedbrydes af mikroorganismerne i plaquen, så de spiller en rolle som næring i substratfattige perioder, men ikke som klæbemateriale i plaquen.
Syreproduktion
Syreproduktionen i plaquen ved bakteriernes forgæring af kulhydrater har stor praktisk betydning, fordi den er årsag til caries. Kulhydrater findes næsten ikke i saliva, men tilføres gennem føde og slik.
Tandplaque & substrat
Sakkarose er altså et eksempel på, at fødekomponenter indvirker på plaquens sammensætning Tandplaque dannes imidlertid også uden hjælp af fødekomponenter, fx hos patienter, som mades med mavesonde.
En væsentlig bestanddel er proteiner fra saliva og gingivalekssudat. Immun globulin A og glykoproteiner fra saliva findes således i plaque og har en udpræget tendens til at bindes til bakterier og forårsage aggregation. Forskellige serumproteiner (albumin, immunglobulin G og A) indgår også i plaquen, fordi de findes i gingivalekssudat.
Menneskets mundflora er altså i stand til at kolonisere tandoverflader alene ved hjælp af saliva.
Symbiose
Mikroorganismernes indbyrdes virkning på hverandre inden for et økosystem er af mindst lige så stor betydning for mikrofloraens balance som de øvrige miljøfaktorer. I de tætte masser af mikroorganismer i plaque forskellige steder i mundhulen spiller organismernes biokemiske aktivitet en stor rolle for hvilke mikroorganismer, der kan trives det pågældende sted, og for hvordan blandingsforholdet bliver imellem de mange forskellige medlemmer af floraen. Både vækstfremmende og væksthæmmende mekanismer er virksomme.
Rene tandflader koloniseres først af en fakultativ flora (overvejende streptokokker), som ved sit stofskifte skaber anaerobe forhold, hvorved der bliver vækstmuligheder for anaerobe bakterier: (aerob-anaerob symbiose).
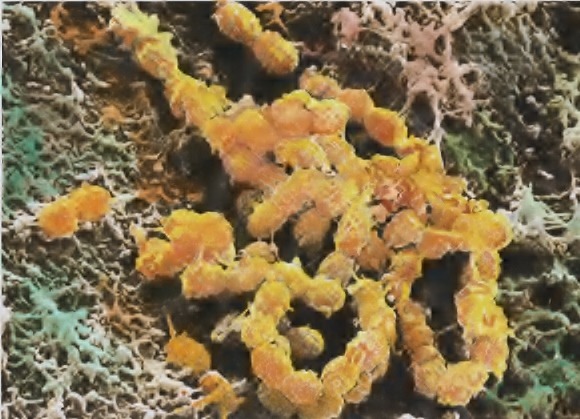
Man kender også mange eksempler på, at en bakterieart i plaquen kan udnytte en anden arts stofskifteprodukt i sin ernæring (ernæringssymbiose). Fx : Corncob (”majskolber”), hvor kokker sidder fast på filamenter ( se illustration ).
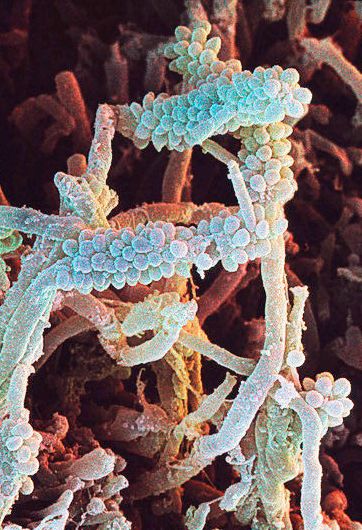
Antagonisme
De væksthæmmende mekanismer kan være konkurrence om substrater. ophobning af stofskifteprodukter kan også hamme bakteriers vækst, fx kan forgæring af kulhydrat medføre et fald i pH i plaque på tænderne til omkring 4 – 5. Kun et fåtal af de orale mikroorganismer kan vokse ved pH under 5. En anden bakteriehæmmende mekanisme er bakteriociner. Disse dannes b1.a. af orale streptokokker og virker dræbende eller hæmmende på andre stammer af samme og beslægtede arter som den bakteriocin-producerende stamme.
Disse eksempler viser, hvordan der indstiller sig en balance imellem blandingsfloraens medlemmer på grund af deres forskellige stofskifteaktiviteter.
Amfibiose
Under ideelle forhold hersker der en balance mellem værtsorganismen og mikrofloraen, idet de i princippet er gensidigt neutrale. De bar dog både gavnlige og skadelige virkninger på hinanden, og balancen er ikke statisk (amfibiose).
Mikrofloraen har således nyttige virkninger for os, men har også under visse omstændigheder forskellige skadevirkninger.
De orale slimhinders mikroflora
De glatte mundslimhinder er koloniseret af en ret sparsom flora af fakultative organismer, overvejende streptokokker tilhørende arten Streptococcus mitior og den dårligt definerede gruppe Streptococcus mitis. Mikroorganismerne sidder fast på de mest overfladiske epitelceller ved hjælp af mekanismer, som tilsyneladende minder om mekanismerne ved kolonisation af tandoverflader. Forsøg bar dog vist, at visse bakterier fortrinsvis sætter sig på epitel, andre på tænder. Mikrofloraens sammensætning på forskellige overflader afspejler sådanne forskelle i bakteriernes evne til at kolonisere dem og svarer derfor ikke til mængdefordelingen i den omgivende saliva. Da epitelcellerne hurtigt af stødes ved slimnindens stadige fornyelse, ser man i reglen ikke større mængder mikroorganismer på de glatte slimhinder.
Tungeplaque
Tungeryggens papiller giver langt bedre retentionsmuligheder, hvorfor man her finder en talrig og kompliceret blandingsflora, som kan benævnes tungeplaque. Tungefloraen minder kun i store træk om floraen i tandplaque. Streptococcus salivarius udgør 25-50% af tungens streptokokflora, men sjældent over 1% af streptokokfloraen i plaque på tænderne. Omvendt findes S. mutans og S. sanguis fortrinsvis i tandplaque og næsten ikke på tungen. På grund af tungens store overflade er tungeryggens flora en ret dominerende del af mundfloraen som helhed. Det ser da også ud til, at mikrofloraen i saliva i stor udstrækning stammer fra tungeryggen, således udgør S. salivarius også ca. 50% af salivas streptokokflora.
[] Billedet viser Streptococcus Salivarius bakterier
Plaquens sammensætning:
– levende (de fleste) mikroorganismer
– døde, henfaldende mikroorganismer
– proteiner fra saliva og gingivalekssudat
– polysakkarider dannet af bakterier
– opløste døde bakterier
– stofskifteprodukter fra bakterier
– næringsstoffer fra saliva, gingivalekssudat og kost
DENTAL PLAQUE
Definition: Bakteriebelægninger på tænder, fyldninger og proteser i mundhulen
Tandbelægninger
Efter tændernes frembrud i munden kan der opstå forskellige former for tandbelægninger. Føderester (debris) kan ses langs tandkødsranden og approksimalt lige efter måltider. De sidder meget løst med mindre de direkte kiles fast, og de fjernes normalt ret hurtigt med spytstrømmen ved hjælp af tungens bevægelser. Der er dog stor forskel på fødemidlers konsistens, klæbrighed, spytstimulerende effekt og på, hvor kraftig tygning de kræver, og derfor fjernes de fra munden med højst forskellig hastighed.
Evne til adhæsion til overflader gælder alle bakterier Evne til at hænge fast, så de ikke skylles væk med spyttet. |
Biofilm
Hovedparten af alle bakterier vokser under normale naturlige forhold i tynde lag som biofilm på overflader. Biofilm dannes med det samme på overflader nedsænket i vandige, naturlige væsker. Dette gælder såvel tænder der bades i mundhulens saliva som skibsskrog der nedsænkes i vand. Speciel hurtig dannelse sker i opløsninger med høj næringstilførsel til bakterier. Hertil hører intravasculære katetre og hjerteklapper i blodbanen, hvor blodet er rigt på næring.
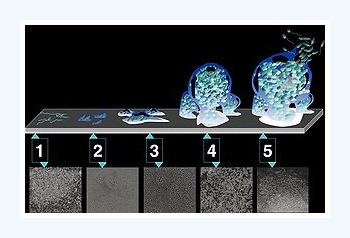
Billedet viser stadier i dannelsen af bakteriebelægninger ved hjælp af biofilm
Tidligere troede man, at biofilm var en fuldstændig homogen, flad belægning, hvor bakterierne bare voksede op i tykkelsen. Sådan er det slet ikke. Bakterierne gror i kolonier, og tit er de utroligt organiserede. Når man ser på en biofilm, er der ofte et netværk af kanaler i den, og man kan spørge sig selv, hvorfor bakterierne danner disse komplicerede strukturer. Er det fordi, de simpelthen styres af mængden af den næring, der findes i deres omgivelser ? Eller skyldes det, at de styres mere overordnet, fordi de selv producerer signalstoffer, som de bruger til at sige: ”Nu er vi faktisk nok her; bliver vi flere, så dør en stor del af os, fordi der er ikke mere næring” ? Man har fundet bevis for, at disse signalstoffer rent faktisk findes, og at de har betydning i naturlige systemer. Det betyder muligvis, at bakterierne regulerer deres vækst for at optimere funktionen af det samlede bakteriesamfund frem for den enkelte bakterie, og så er det lige før, at bakterierne tilsammen fungerer som en flercellet organisme.
Biofilmen beskytter bakterierne mod antimikrobielle midler.
Behandling med antimikrobielle midler er ofte uden succes medmindre belægningen fjernes mekanisk
Derfor er en tandbørste så effektiv.
Biofilm opbygning
Inderste lag tæt lag af mikroorganismer i polysakkarid matrix og organisk & uorganisk materiale
Mellemste lag løsthængende, ujævn udstrakt ind i omgivende medium
Yderste lag, grænselag af væske Sublag (stationært)
Supralag (flydende)
Dental plaque repræsenterer en SAND BIOFILM
Pellikel
En biofilm-type er den erhvervede pellikel , der er en tynd (0.1-0.5 µm) strukturløs hinde bestående af glykoproteiner fra saliva. Et tyndt lag af proteiner dannes på få minutter på alt, hvad der kommer i kontakt med saliva (tænder, tanderstatninger, føde, slimhinder).
På tænderne sker der en selektiv adsorption af visse glykoproteiner, som har særlig høj affinitet til tandoverfladen, muligvis fordi de har negative ladninger og derfor bindes til kalciumioner i hydroksylapatit. I pelliklen findes kun enkelte spredte bakterier indlejret under proteinernes adsorption.
Pelliklen kan muligvis til en vis grad beskytte tandoverfladen mod kemiske påvirkninger.
På overfladen af plaquen kan der findes spredte leukocytter, epitelceller og føderester, men disse ses ikke i de dybere lag.
Plaque-dannelsen
Plaquen kan opfattes som en lokaliseret overvækst af den normale mundflora, som medfører en forskydning i balancen mellem værtsorganisme og mikroflora.
Plaquedannelse består i en mikrobiel kolonisation af tandoverfladerne med bakterier. Mundens mikroflora er karakteriseret ved sin udprægede evne til at sidde fast på overflader, hvorved den forbliver i munden trods den stadige strøm af saliva.
Mens mængden af mikroorganismer på slimhinderne begrænses af den stadige fornyelse og afskalning af epitelet, kan store mængder ophobes uforstyrret på tænderne
Supragingival plaque
På tændernes glatte flader starter plaquedannelse med, at der på den nyrensede emalje straks dannes en biofilm (pellikel), og derefter sker der en selektiv adsorption til den erhvervede pellikel af visse bakterier fra saliva, mest streptokokker og actinomyces. Ud fra disse første, spredte bakterier dannes stadig større klumper ved at flere kommer til fra spyttet og sætter sig fast på de første på grund af en udpræget tendens til sammenklumpning (aggregation). Klumperne vokser også ved formering af bakterierne. De ligner i begyndelsen kolonier på en agarplade og kaldes for plaquekolonier, men de indeholder helt fra starten en blanding af forskellige bakteriearter.
Efterhånden vokser plaquekoloniernes størrelse og antal, så de smelter sammen til en sammenhængende belægning. Selv efter en grundig tandbørstning eller tandrensning kan der sidde bakterier tilbage i små revner og fordybninger i tandoverfladerne. Vækst af disse efterladte bakterier bidrager også til plaquedannelse.
Bakterierne sidder fast på tænderne med flere forskellige mekanismer.
Adsorptionen kan ske ved, at nogle bakteriers cellevægge har en særlig affinitet til pelliklens glykoprotein, mens andre kan sidde fast på glatte overflader ved hjælp af EPS, som de danner ud fra sakkarose.
Aggregationen kan skyldes en direkte sammenbinding af forskellige bakteriearters celler ved hjælp af deres cellevægge. Medvirkende er desuden proteiner fra saliva eller gingivalekssudat Både glykoproteiner, albumin og immunglobuliner er påvist i plaque og kan aggregere bakterier.
EPS kan også forårsage aggregation. Det er meget individuelt forskelligt, hvor hurtigt plaque dannes og i hvor store mængder. Plaque dannes hurtigst på ru tandoverflader og fyldninger og hos patienter med gingivitis, idet gingivalekssudat og bakterier i tandkødslommerne fremmer plaqueudviklingen.
De første afsæt af bakterier på pellikel tabes let. Beskyttelsen af bakterierne er væsentlig; fx glatte flader versus furkaturer.
Gingivitis fremmer plaquedannelseshastigheden
Hvis tænderne rengøres omhyggeligt hver dag, bliver tandkødet sundt, og plaque dannes forholdsvis langsomt. I reglen ses plaquekolonier fra få timer til 1-2 døgn efter tandbørstning, og sammenhængende plaque ses efter 1-3 døgn.
Mens pelliklen dækker alle tandflader, er plaquens udbredelse begrænset til områder, som er beskyttet mod gnidning fra føde, læber, kind og tunge. Plaquedannelsen sker mest uforstyrret langs gingivalranden approksimalt, facialt og lingualt.
Hvor langt koronalt man finder plaque afhænger af, hvordan den mekaniske påvirkning fra føde og muskler er. Således kan kraftig tygning af hård føde (æbler, rå gulerødder) i nogen grad hæmme udbredelsen i okklusal retning på facial- og lingualflader, men påvirker ikke plaquedannelsen approksimalt og gingivalt.
Kraftig tygning og stærk spytsekretion i forbindelse hermed kan nok fremskynde fjernelsen af madrester, men fjerner ikke plaque.
Subgingival plaque
Subgingival plaque kan dannes ved nedvækst af supragingival plaque i tandkødslommen, så de to former udgør en sammenhængende belægning på tanden. I den apikale del har plaquen dog ofte en løsere struktur, og mange bakterier ligger mellem epitel og tand uden egentlig at hænge fast. I dybe patologiske pocher ser man desuden spredte kolonier, som synes opstået ved at enkelte bakterier eller små klumper er trængt længere apikalt.
Ved dybe pocher kan der ske en invasion af bakterier i rodens dentintubuli. Selv efter omhyggelig depuration vil vækst fra disse kolonier i dentintubuli medfører en hurtig rekolonisation af pochen.
Sammenhæng mellem plaque og inflammation
Ved komplet plaquefjernelse efter 2dg/48h forhindres gingivitis. Plaquedannelse starter approximalt præ-&molarer. Derefter approximalt ved alle tænder. Til slut facialt. Facialflader har mindste plaquemængde. Mindst centraler i OK. Generelt: Højest antal bakterier approximalt. Flere bakterier facialt end lingualt. Flere posteriort end anteriort.
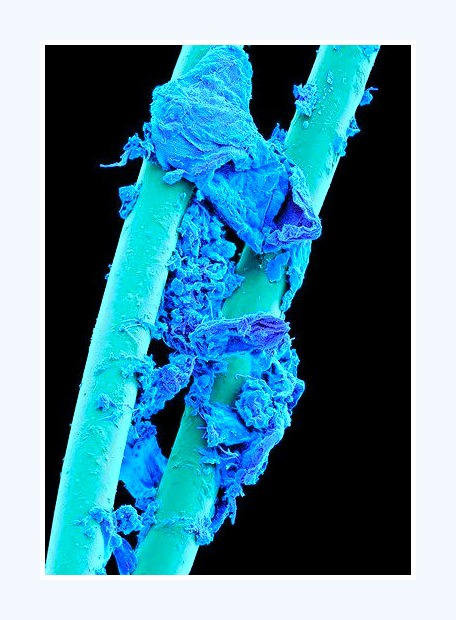
Billedet viser plaque på brugt tandtråd

Billedet viser plaque på et brugt tandbørstehår
Gingivitis – tandkødsbetændelse
Større ansamlinger af plaque langs gingival randen fører til gingivitis og en anden sammensætning af plaquefloraen. Først og fremmest finder man nu et øget antal gram-negative og anaerobe bakterier, idet Bacteroides og Fusobacterium prolifererer. Streptococcus og Actinomyces arter dominerer stadig blandt de gram-positive fakultative bakterier.
Ved sund gingiva findes få bakterier, og det er næsten udelukkende gram-positive kokker, men ophører rensning af gingivalområdet, udvikler plaquen sig:
I første fase ses et øget antal gram-positive kokker, mange gram-positive stave, og nogle få gram-negative kokker og små stave.
Efter 2-4 dage optræder i anden fase af plaque-dannelsen desuden filamenter og gram-negative lange stave;
og efter 7-10 dage er plaquen udviklet til tredje fase, hvor der yderligere findes gram-negative, buede stave (spiriller) og spirokæter.
Marginal parodontitis
Samtidig med overgangen til parodontitis med tab af epitelfæste og dermed patologisk fordybede pocher ses en glidende overgang til en bakterieflora, som karakteristisk er rig på anaerobe bakterier. Det drejer sig b1.a. om spirokæter, som i almindelighed ikke kan dyrkes i laboratoriet, men ses i mikroskopet. Spirokæterne findes i de dybe dele af pocherne i stort set alle tilfælde af fremskreden parodontitis. Desuden findes forskellige arter af Fusobacterium, Bacteroides og andre gram–negative stave. Der kan være ganske store variationer mellem plaquefloraen hos forskellige personer med parodontitis og selv mellem floraen i forskellige pocher hos samme person med samme kliniske billede. Det afspejler måske, at der er tale om en vekslen mellem progression og remission af sygdommen med henholdsvis nedbrydning og genopbygning af epitelfæstet.
Juvenil parodontitis (JP)
Juvenil parodontitis JP er en sygdom hos unge mennesker, som er karakteriseret ved hurtigt tab af epitelfæste og vertikalt svind af alveoleknogle. Ved overordentlig omhyggelig mundhygiejne forsvinder symptomerne, og det er naturligvis et godt tegn på, at sygdommens årsag er plaquebakterier, selv om der karakteristisk ikke ses store plaquemængder som ved kronisk marginal parodontitis.
Ved dyrkning af plaquen finder man overvejende forskellige gram-negative stave.
Actinobacillus actinomycetemcomitans (A.a.) & JP
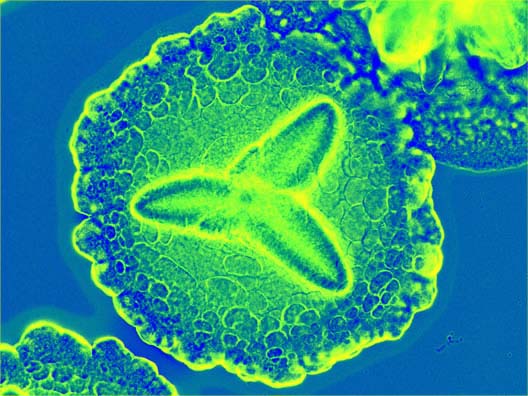
Nogle mener, at Actinobacillus actinomycetemcomitans, forkortet A.a. , (reklassificeret som Aggregatibacter actinomycetemcomitans i 2006) er særlig vigtig, blandt andet fordi patienter med juvenil parodontitis JP har en signifikant forøget antistoftiter mod denne bakterie. Hos forsøgsdyr fremkalder den parodontitis med kraftigt alveolært knoglesvind. Lipopolysakkarid LPS fra dens cellevæg fører til knogleresorption i vævskultur. LPS virker som antigen[1] kraftigt stimulerende på antistofdannelsen.
Og endelig danner nogle stammer af denne bakterie et leukotoksin, som dræber både polymorfkernede neutrofile granulocytter PMN og monocytter. Det er formodentlig dette leukotoksin, der er årsag til, at man kan påvise en nedsat respons på kemotoksiske stimuli og nedsat evne til fagocytose hos leukocytter fra patienter med juvenil parodontitis JP.
Akut Nekrotiserende Gingivitis (ANG)
Denne sygdoms ætiologi er endnu et åbent spørgsmål. Man ved ikke med sikkerhed, om den skyldes ændret resistens hos mennesket, en hypersensibilitetsreaktion, en særlig sammensætning af plaquen, optræden af en eller flere specielt patogene bakterier, eller måske en kombination af disse fænomener. Der er tilsyneladende en synergistisk virkning af fusobakterier og spirokæter, idet de to bakteriearter sammen gav anledning til en kraftigere inflammation end enkeltvis.
Yderligere findes der i plaque ved fremskreden og kraftig gingivitis også talrige spirokæter og fusobakterier. Det er karakteristisk, at der ved ANG findes en invasion af plaquebakterier, navnlig spirokæter, i gingivas epitel og bindevæv. Normalt findes bakterierne uden for epitelet, men ved denne sygdom sker en indtrængen i vævet. Spirokætere er også fundet i alveoleknogle ved ANG

Billedet viser en skematisk illustration af en Spirokæter
[1]antigen : Stof som ved indførsel i organismen fremkalder antistoffer.